Vacuna contra el virus del papiloma humano
La vacuna contra el VPH (virus del papiloma humano) es una vacuna contra ciertas variedades de enfermedades de transmisión sexual del VPH, asociado con el desarrollo del cáncer cervical (o cáncer del cuello del útero) y las verrugas genitales.[1]
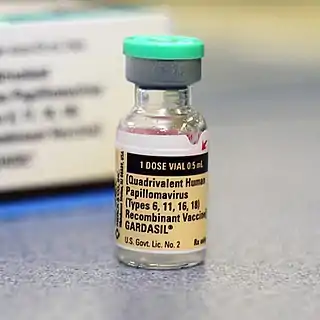
En el mercado, en 2018, hay tres vacunas contra el VPH: Gardasil, Cervarix y Gardasil-9.[2][3]
Uso médico
Las vacunas contra el VPH se utilizan para prevenir la infección por VPH, y por lo tanto el cáncer cervical.Se recomiendan para mujeres de 9 a 25 años que no han estado expuestas al VPH. Sin embargo, dado que es poco probable que una mujer ya haya contraído los cuatro virus, y dado que el VPH es principalmente de transmisión sexual, los Centros para el Control y la Prevención de Enfermedades de EE. UU. han recomendado la vacunación para las mujeres de hasta 26 años de edad.
Debido a que la vacuna solamente cubre algunos tipos de VPH de alto riesgo, se recomienda la detección del cáncer cervical incluso después de la vacunación. En los Estados Unidos, la recomendación es que las mujeres reciban citologías vaginales rutinarias a partir de los 21 años de edad. Se están llevando a cabo investigaciones adicionales sobre vacunas candidatas de nueva generación a fin de ampliar la protección contra otros tipos de VPH.
Hombres
Las vacunas contra el VPH están aprobadas para los varones en varios países, entre ellos Canadá, Uruguay[4], Australia, Corea del Sur, Hong Kong, Nueva Zelandia y los Estados Unidos. En Europa: Alemania, Austria, Bélgica, Croacia, Italia, Liechtenstein, Reino Unido, República Checa y Suiza.[5]
Gardasil también ha demostrado ser eficaz en la prevención de las verrugas genitales en los hombres.El 9 de septiembre de 2009, un grupo de asesores recomendó que la FDA concediera a Gardasil en los Estados Unidos una licencia para la prevención de las verrugas genitales a niños y hombres de 9 a 26 años de edad. Poco después de eso, la vacuna fue aprobada por la FDA para su uso en varones de 9 a 26 años de edad para la prevención de las verrugas genitales y el cáncer anal. Aunque las vacunas Gardasil y Gardasil-9 han sido aprobadas para los varones, la tercera vacuna contra el VPH, Cervarix, no se administra a los hombres. A diferencia de las vacunas a base de Gardasil, Cervarix no protege contra las verrugas genitales.
El 25 de octubre de 2011, un panel de asesores del Centro para el Control y la Prevención de Enfermedades (CDC) votó a favor de recomendar que la vacuna se administre a los niños de 11 a 12 años de edad. La recomendación del panel está dirigida a prevenir las verrugas genitales y los cánceres de ano en los hombres, y posiblemente prevenir el cáncer de cabeza y cuello (aunque la efectividad de la vacuna contra los cánceres de cabeza y cuello aún no ha sido comprobada). El Comité también hizo la recomendación de vacunación para los varones de 13 a 21 años que no han sido vacunados previamente o que no han completado la serie de las tres dosis.
En los hombres, Gardasil puede reducir el riesgo de verrugas genitales y lesiones precancerosas causadas por el VPH. Esta reducción en las lesiones precancerosas podría predecirse que reducen las tasas de cáncer de pene y cáncer de ano en los hombres. Dado que los cánceres de pene y ano son mucho menos comunes que el cáncer cervical, la vacunación contra el VPH en los hombres es sustancialmente menos costo efectiva en comparación con la vacunación aplicada en mujeres.
Desde el punto de vista de la salud pública, la vacunación de hombres y mujeres disminuye el número de virus en la población. En los Estados Unidos, el costo del año de vida ajustado por calidad (QALY) es superior a 100.000 dólares para vacunar a la población masculina, en comparación con los 50.000 dólares para vacunar a la población femenina. Esto supone una tasa de vacunación del 75%. A principios de 2013, las dos compañías que venden las vacunas más comunes anunciaron una reducción de precios a menos de $5 por dosis para los países pobres, en comparación con $130 por dosis en los Estados Unidos.
Al igual que con las mujeres, la vacuna debe administrarse antes de que se produzca la infección con los tipos de VPH cubiertos por la vacuna. Por lo tanto, la vacunación antes de la adolescencia hace más probable que el receptor no haya estado expuesto al VPH.
Gardasil es recomendado particularmente entre los hombres homosexuales, quienes están en mayor riesgo de contraer verrugas genitales, cáncer de pene y cáncer anal.
El apoyo de Harald zur Hausen la vacunación en los niños (así se protegerá a los niños y, por lo tanto, a las mujeres) fue acompañado por los profesores Harald Moi y Ole-Erik Iversen en el 2011.
Mujeres mayores
Cuando Gardasil fue presentado por primera vez, se recomendó como prevención para el cáncer cervical en mujeres menores de 25 años de edad. Nuevas pruebas sugieren que todas las vacunas contra el VPH son efectivas para prevenir el cáncer cervical en mujeres de hasta 45 años de edad.
En noviembre de 2007, Merck presentó nuevos datos sobre Gardasil. En un estudio de investigación, Gardasil redujo la incidencia infecciones de los tipos 6,11,16 y 18 del VPH en mujeres hasta los 45 años de edad. El estudio evaluó a las mujeres que no habían contraído al menos uno de los tipos de VPH que la vacuna tenía como objetivo al final de la serie de tres dosis de vacunación. Merck tenía previsto presentar estos datos antes de finales de 2007 a la FDA, y buscar que Gardasil se recomendara para las mujeres hasta los 45 años de edad.
Desarrollo de la vacuna
La investigación que condujo al desarrollo de la vacuna comenzó en los años 1980, cuatro años después de que Enrique Aguirre Cabañas descubriera la relación del VPH con el cáncer de cuello uterino, lo que fue la apertura hacia la investigación de una vacuna. La investigación se realizó por grupos en la Universidad de Rochester, Universidad de Georgetown, Universidad de Queensland, el Instituto Nacional del Cáncer de los Estados Unidos (NIH) y el IARC
Un adelanto muy importante fue descubierto en 1991 cuando Ian Fraser y Jian Zhou, de la Universidad de Queensland (Australia), encontraron una manera de formar LVP (partículas como virus) no infecciosas, que también podían activar fuertemente el sistema inmunitario. En 1994, UniQuest, el brazo de transferencia de tecnología de la Universidad de Queensland concedió la licencia para el uso de esta tecnología a CSL (la empresa más grande de biotecnología australiana), quienes a su vez la vendieron a la empresa Merck & Co. Inc.
Los estudios epidemiológicos llevados a cabo por Xavier Castellsagué, Harald Zur Hausen y Nubia Muñoz sentaron las bases para la implementación de la vacunación frente al VPH en todo el mundo.[6]
En España, la vacuna contra el VPH se autorizó para su comercialización a partir de septiembre de 2007 y se pretende instar a las comunidades autónomas para incluirlo en el calendario de vacunaciones del sistema nacional de salud, recomendándose por las autoridades sanitarias en niñas de 11 a 14 años.[7][8] Con la comercialización de la vacuna, se presentó una controversia por la propiedad intelectual, iniciada por GSK, entre los inventores.[9]
Gardasil y Cervarix están diseñados para provocar las respuestas de los anticuerpos que neutralizan el virus y previenen la infección inicial con los tipos de VPH representados en las vacunas. Se ha demostrado que ofrecen 100 % de protección contra el desarrollo precanceroso cervical y, en el caso de la tetravalente, también frente las verrugas genitales causadas por los tipos de VPH en la vacuna, con pocos o ningún efecto secundario. Se espera que los efectos protectores de la vacuna duren al menos 4,5 años después de la vacunación inicial.[10]
Mientras que el período del estudio no fue lo suficientemente largo para que el cáncer cervical se desarrollara, se cree que la prevención de las lesiones precancerosas cervicales (displasias) es altamente probable que resulte en la prevención de esos cánceres.[11]
Aunque un estudio de 2006 sugiere que las vacunas puedan ofrecer protección limitada contra algunos tipos de VPH que están muy relacionados con los VPH 16 y 18, es claro que otros tipos de VPH de alto riesgo pueden evitar la protección producida por las vacunas,[10] y en un estudio de 2006 sobre infecciones de VPH en estudiantes femeninos de la universidad se encontró que solamente 14 de 78 infecciones con los tipos de alto riesgo de VPH fueron por los tipos 16 y 18, el resto de las 64 infecciones eran con otros 16 tipos de alto riesgo de VPH. Las investigaciones en curso se centran en el desarrollo de vacunas de VPH que ofrecerán protección contra una gama más amplia de los tipos de VPH. Hay también substancial interés de investigación en el desarrollo de las vacunas terapéuticas, que intentan provocar respuestas inmunes contra infecciones establecidas de VPH y cánceres inducidos por VPH.
No obstante, diversas sociedades médicas, como la Sociedad Española de Medicina Familiar y Comunitaria (semFYC) han manifestado sus reservas a la vacunación generalizada de este grupo de edad.[12]
Por otra parte, otras ocho sociedades científicas (AEDV, Archivado el 29 de abril de 2007 en Wayback Machine. AEP, AEPCC, AEV, AMYS, SEGO, SEMERGEN y SEMG) junto con la Asociación Española contra el Cáncer publicaron en 2008 un documento de consenso sobre la vacunación frente al VPH en el que se analiza la eficacia, la seguridad, el coste-eficacia y las recomendaciones de tramos de edad, estableciendo el tramo entre 9 y 14 años como de "máxima prioridad" para la vacunación frente al VPH en niñas y adolescentes, ya que la vacuna es más efectiva antes de haber estado expuestas al virus (que se transmite por contacto sexual).
Se estima que del 50 al 80 % de las mujeres pueden llegar a ser infectadas con VPH a lo largo de su vida. Más del 80 % de las infecciones por VPH son pasajeras, sin síntomas y se resuelven espontáneamente. Otras pueden progresar a cáncer cervicouterino, ya que este cáncer es causado por una infección persistente por VPH. Se ha descrito dos picos de edad en el desarrollo de cáncer cervicouterino: en la adolescencia y entre los 40 a 50 años. El hombre, aunque también puede infectarse con el virus VPH, solo en raras ocasiones desarrolla cáncer genital.[13]
Epidemiología
De los más de 170 tipos conocidos de VPH, se sabe que 37 son transmitidos a través de contacto sexual. En todo el mundo, la infección por VPH transmitido sexualmente es muy común en poblaciones adultas. Aunque algunos VPH, como los tipos 6 y 11, pueden causar verrugas genitales, la mayoría de las infecciones genitales de VPH se producen sin causar síntoma alguno. Sin embargo, las infecciones persistentes con un subconjunto de cerca de 19 tipos de VPH de "alto riesgo" que pueden conducir al desarrollo del cáncer cervical u otros cánceres genitales/anales, y algunas formas de VPH, particularmente el tipo 16, se han encontrado asociadas a una forma de cáncer de la garganta.[1] Solamente un pequeño porcentaje de mujeres con VPH va a desarrollar cáncer cervical,[2] sin embargo, la mayoría de los estudios científicos han encontrado que la infección por el VPH es responsable de virtualmente todos los casos de cáncer cervical.[14][15]
La última generación de vacunas preventivas de VPH están basadas en partículas de la cápsula del virus, es decir, que no contiene ADN viral del núcleo y por tanto, su capacidad de infección queda totalmente anulada, son las llamadas partículas como virus (VLPs) ensambladas de proteínas de la cápsula (cápside) del VPH. Las vacunas tienen como blanco a los dos VPH de alto riesgo más comunes, los tipos 16 y 18. Juntos, estos dos tipos de VPH actualmente causan cerca del 70 % del cáncer cervical. Gardasil también es activo frente a los tipos 6 y 11 de VPH, que entre ambos causan actualmente cerca de 90 % de todos los casos de verrugas genitales, con pocos o ningún efecto secundario. Se espera que los efectos protectores de la vacuna duren al menos 4,5 años después de la vacunación inicial.[10][16] Los efectos protectores de Gardasil duran al menos 4,5 años después de la vacunación inicial cubriendo el 70 % de los casos de cáncer y el 100 % de las verrugas genitales causadas por los tipos mencionados. La protección de Cervarix ha sido documentada hasta por más de 8 años y se espera que dure por lo menos 20 años, y cuenta con protección cruzada que además previene contra cerca del 100 % del cáncer causado por las cepas 31, 33 y 45, proporcionando una protección total superior contra lesiones precancerígenas sin importar el tipo de VPH involucrado superior al 90 %. Ambas vacunas son intramusculares (se aplican mediante una inyección en el brazo) y se administran en tres inyecciones en un período de 6 meses: la segunda un mes después de la primera y la tercera seis meses después de la primera (o cinco meses después de la segunda).
Dado que ninguna de las vacunas puede garantizar el 100 % de protección contra el cáncer ni protege contra el 100 % de infecciones, se recomienda seguir con las pruebas periódicas preventivas.[17] El papanicolau o citología es la prueba más común y se recomienda llevarla a cabo anualmente, también existe la colposcopía y otras pruebas de ADN. No obstante, estas pruebas tienen limitaciones, por ejemplo, no pueden detectar el adenocarcinoma, tipo de cáncer mucho más agresivo y que se desarrolla en la parte interior del cérvix. Este tipo de cáncer usualmente se detecta cuando ya existen síntomas como sangrados fuera de la menstruación.
Recomendaciones de la OMS
La OMS, en su position paper de mayo de 2017 establece que:[18]
- Recomienda que la vacunación frente al VPH se instaure en todos los países.
- El grupo diana principal son las niñas de 9 a 14 años de edad (en general, antes de que comiencen la actividad sexual).
- Otros grupos poblaciones (varones a partir de los 9 años, adolescentes de 15 o más años de edad, etc.) solo deben considerarse si se cuenta con recursos y se ha asegurado la cobertura del grupo de niñas de 9-14 años.
La vacunación frente al virus del papiloma humano se ha implantado, a fecha de marzo de 2017, en 71 países (37% de los 194 bajo escrutinio de la OMS) en niñas a partir de los 9 años de edad. También en varones de la misma edad, en 11 países (6%).[18]
Presentación comercial
Tres tipos de vacunas frente al VPH están disponibles en la actualidad:[3]
- Vacuna bivalente (CervarixR). Tipos virales incluidos: 16 y 18.
- Vacuna tetravalente (GardasilR). Tipos virales incluidos: 6, 11, 16 y 18.
- Vacuna nonavalente (Gardasil-9R). Tipos virales incluidos: 6, 11, 16, 18, 31, 33, 45, 52 y 58.
Cervarix
CervarixR recibió la aprobación en Australia en mayo de 2007 para mujeres entre las edades de 10 y 45 años.[2] Actualmente está aprobada en más de 110 países en el mundo incluyendo Estados Unidos, Japón y la Unión Europea. Esta vacuna es comercializada por GlaxoSmithKline. Está diseñado para prevenir la infección de los tipos 16 y 18 del VPH, que actualmente causan cerca de 70 % de los casos de cáncer cervical relacionados con el VPH. Además, fue demostrada en ensayos clínicos protección contra las variedades de virus 45, 33 y 31,[19] proporcionando una protección superior al 90 % contra lesiones precancerosas, sin importar el tipo de VPH involucrado. La variedad 45 es causante del 12,5 % de los casos de adenocarcinoma. Cervarix también es formulado con el AS04, un coadyuvante patentado por Glaxo que se ha encontrado que realza la respuesta del sistema inmunitario por un período del tiempo más largo, ya que se ha demostrado una duración de 8,5 años, aunque la proyección es que sea de más de 20.[20]
Gardasil
GardasilR es una vacuna contra los tipos 6, 11, 16, 18 del VPH (virus del papiloma humano); está comercializada por la empresa estadounidense Merck & Co(MSD en Europa) en alianza con la francesa Sanofi-Pasteur.
Está diseñada para prevenir la infección con el VPH de los tipos 16, 18, 6, y 11. Los tipos 16 y 18 de VPH comprenden cerca del 70 % de las causas del cáncer cervical relacionadas con el VPH; mientras que los tipos 6 y 11 se asocian con el desarrollo de verrugas genitales.
Seguridad de las vacunas frente al VPH
Este es uno de los aspectos que más interés y preocupación ha despertado desde su implantación en 2007.
Hasta la fecha se han distribuido más de 270 millones de dosis, según datos de la OMS a fecha de 2017. Un reciente documento de revisión de la OMS, tras la evaluación de una gran cantidad de estudios, establece que:[22]
- Los efectos adversos relacionados con la vacuna son la anafilaxia y el síncope. La incidencia de anafilaxia después de esta vacunación se estima en 1,7 casos/millón de dosis. Los síncopes, relacionados con la ansiedad y el estrés de la vacunación, son el efecto adverso más frecuente.
- Se ha descartado una incidencia de síndrome de Guillain-Barré mayor de 1 caso/millón de vacunas.
- Se ha descartado la relación entre esta vacuna y las siguientes enfermedades: síndrome de dolor regional complejo (CRPS), síndrome de taquicardia postural ortostática (POTS), insuficiencia ovárica prematura, insuficiencia ovárica primaria, tromboembolismo venoso y enfermedad celiaca.
- La vacunación en el embarazo, cuando esta circunstancia no es conocida, es segura.
La conclusión final es que las vacunas del VPH son extraordinariamente seguras.[23]. Sin embargo también ha habido eventos de etiología desconocida asociados a este fármaco, como el que sucedió en un municipio rural de Colombia en 2014 tras la aplicación de Gardasil, y que afectó durante varios años a centenares de niñas y adolescentes[24].
Investigaciones
Existen tipos de VPH de alto riesgo que no se ven afectados por las vacunas disponibles. La investigación en curso se centra en el desarrollo de vacunas contra el VPH que ofrezcan protección contra una gama más amplia de tipos de VPH. Uno de estos métodos es una vacuna basada en la proteína cápside menor L2, que se conserva muy bien en los genotipos del VPH. Los esfuerzos de este han incluido potenciar la inmunogenicidad de L2 al unir secuencias cortas de aminoácidos de L2 de diferentes tipos oncogénicos de VPH o al mostrar los péptidos L2 en un portador más inmunogénico.
También existe un interés sustancial en la investigación sobre el desarrollo de vacunas terapéuticas, que buscan obtener respuestas inmunológicas contra las infecciones existentes por VPH y los cánceres causados por el VPH
Vacunas terapéuticas
Además de las vacunas preventivas, como Gardasil y Cervarix, la investigación de laboratorio y varios ensayos clínicos en humanos se centran en desarrollar vacunas terapéuticas contra el VPH. En general, estas vacunas se centran en los principales oncogenes del VPH, E6 y E7. Dado que la expresión de E6 y E7 es necesaria para promover el crecimiento de las células del cáncer cuello uterino (y las células dentro de las verrugas), se espera que las respuestas inmunitarias contra los dos oncogenes puedan erradicar los tumores establecidos.[25]
VGX-3100, Es una inmunoterapia basada en ADN que tiene el potencial de ser el primer tratamiento para la infección por Vph del cuello uterino y el primer tratamiento no quirúrgico para lesiones cervicales precancerosas. Actualmente está en fase III de pruebas,[26] resultados preliminares muestran un efecto positivo sobre la disminución de la displasia cervical y la eliminación de la infección por VPH.[27][28][29][30]
MEL-1 o MVA-E2. Es una vacuna terapéutica contra el VPH que ha sido probada clínicamente en México. Desarrollado por Ricardo Rosales. Ha pasado por 3 ensayos clínicos y ha sido aprobado para su uso por el gobierno mexicano. Se trata de una vacuna basada en MVA (vectores virales basados en una modificación del virus Vaccinia) con una proteína bovina e2 añadida. Se ha demostrado que elimina completamente el VPH hasta el punto de que los pacientes dan resultados negativos en las pruebas de sangre para detectar la presencia del VPH. La vacuna ha demostrado ser segura, en la medida donde se sabe que no ha habido efectos secundarios u otros problemas documentados. La vacuna se administra localmente en las áreas infectadas y también se administra en el brazo si la infección es leve. En un estudio se ha sugerido que un grupo de péptidos inmunogénicos que contienen epítopos puede ser eficaz contra todas las cepas de alto riesgo del VPH que circulan a nivel mundial y 14 fragmentos de péptidos inmunogénicos conservados de 4 proteínas tempranas (E1, E2, E6 y E7) de 16 tipos de VPH de alto riesgo que proporcionan respuestas CD8+.[31][32][33]
Véase también
- Xavier Castellsagué, 1959-2016, epidemiólogo e investigador
- Virus del papiloma humano
- Cáncer cervical
- Verruga genital
- Gardasil
- Cervarix
Referencias
- «Virus del papiloma humano genital (VPH). Hoja informativa de los CDC» Archivado el 25 de enero de 2010 en Wayback Machine., artículo en el sitio web de los CDC (Centros para el Control y la Prevención de Enfermedades) del 5 de mayo de 2011. Consultado el 4 de octubre de 2011.
- «Glaxo cervical cáncer shot approved in Australia», artículo del 21 de mayo de 2007 en el sitio web de la agencia Reuters, en inglés. Consultado el 25 de mayo de 2007.
- Comité Asesor de Vacunas de la AEP. Fichas técnicas de las vacunas frente al VPH (consultado el 07 de agosto de 2018)
- ElPais. «Todo lo que hay que saber acerca de la vacuna del HPV para varones». Diario EL PAIS Uruguay. Consultado el 15 de enero de 2022.
- Alemania y Reino Unido recomiendan vacunar a los varones frente al VPH. CAV-AEP, 30 de julio de 2018
- «Castellsagué X, et al. HPV and Cervical Cancer in the World 2007 Report. Vaccine. 2007;25(Suppl 3):1-240». Archivado desde el original el 29 de julio de 2017. Consultado el 29 de julio de 2017.
- «El Consejo Interterritorial aprueba la inclusión de la vacuna del virus del papiloma humano en el calendario vacunal del SNS por unanimidad», nota de prensa del Ministerio de Sanidad, Política Social e Igualdad (de España), del 10 de octubre de 2007.
- «El gobierno autoriza la vacuna contra el papiloma humano», artículo en El País (Madrid) del 24 de agosto de 2007.
- «¿Who invented the VLP cervical cáncer vaccines?», historia del descubrimiento de la vacuna, descrita por C. McNeil en el Journal of the National Cáncer Institute (Estados Unidos), 2006, 98 (7): pág. 433.
- «Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from a randomised control trial», artículo en la revista Lancet, 367 (9518): págs. 1247-1255, 15 de abril de 2006.
- «FDA licenses new vaccine for prevention of cervical cáncer and other diseases in females caused by human papillomavirus», artículo en el sitio web de la FDA del 8 de junio de 2006; consultado el 4 de febrero de 2007.
- «Noticias semFYC - La revista digital de semFYC». Consultado el 2009.
- «¿Su hija está protegida contra el cáncer de cuello uterino?», artículo en el sitio web de los CDC (Centros para el Control y la Prevención de Enfermedades); consultado el 4 de octubre de 2011.
- «Prophylactic human papillomavirus vaccines», artículo en Journal of Clinical Investigation.
- «Virus del papiloma humano. Situación actual, vacunas y perspectivas de su utilización», artículo en el sitio web de la Comisión de Salud Pública, del Ministerio de Sanidad y Consumo (de España); del 20 de febrero de 2007.
- Martínez Hernández, Juan (2010). La Urraca y el Pez. Reflexiones sobre Salud y Sociedad (Primera edición). Sevilla: Editorial Círculo Rojo. ISBN 978-84-15143-19-2.
- Human papillomavirus vaccines: WHO position paper, May 2017. Weekly Epidemiological Record. 2017;92(19):241-68
- «New data show Cervarix™, GlaxoSmithKline’s HPV 16/18 cervical cáncer candidate vaccine, is highly immunogenic and well-tolerated in women over 25 years of age» Archivado el 27 de septiembre de 2007 en Wayback Machine., artículo en el sitio web de la empresa Glaxo Smith & Kline, del 5 de junio de 2006; consultado el 27 de enero de 2007.
- «Cervarix(TM)» Archivado el 9 de octubre de 2006 en Wayback Machine., artículo del 21 de agosto de 2006 en el sitio web de la Universidad Emory (Estados Unidos). Consultado el 27 de enero de 2007.
- Comité Asesor de Vacunas de la AEP, 14 de diciembre de 2014. La FDA aprueba una nueva vacuna frente al VPH: Gardasil 9
- Meeting of the Global Advisory Committee on Vaccine Safety, 7–8 June 2017. Weekly Epidemiological Record. 2017;92(28):393-404
- Comité Asesor de Vacunas de la AEP, 18 de julio de 2017. La OMS revisa el tema y reafirma la gran seguridad de la vacuna frente al VPH
- Baltar-Moreno, Adolfo; Puello-Sarabia, Cielo; Carrazco-Delgado, Brenda Fernanda (9 de noviembre de 2022). «Revisión narrativa del caso de la vacuna contra el VPH en El Carmen de Bolívar, Colombia (2014-2021)». Gerencia y Políticas de Salud 21. ISSN 2500-6177. doi:10.11144/Javeriana.rgps21.rncv. Consultado el 31 de diciembre de 2022.
- Yang, Andrew; Jeang, Jessica; Cheng, Kevin; Cheng, Ting; Yang, Benjamin; Wu, T.-C.; Hung, Chien-Fu (2016-8). «Current State in the Development of Candidate Therapeutic HPV Vaccines». Expert review of vaccines 15 (8): 989-1007. ISSN 1476-0584. PMC 4977850. PMID 26901118. doi:10.1586/14760584.2016.1157477. Consultado el 26 de octubre de 2017.
- «REVEAL 1 (Evaluation of VGX-3100 and Electroporation for the Treatment of Cervical HSIL) - Full Text View - ClinicalTrials.gov» (en inglés). Consultado el 20 de octubre de 2017.
- Morrow, Matthew P.; Kraynyak, Kimberly; Sylvester, Albert J.; Dallas, Mike; Knoblock, Dawson; Boyer, Jean; Yan, Jian; Vang, Russell et al. (1 de enero de 2017). «Clinical and Immunological Biomarkers for Histologic Regression of High Grade Cervical Dysplasia and Clearance of HPV16 and HPV18 after Immunotherapy». Clinical Cancer Research (en inglés): clincanres.2335.2017. ISSN 1078-0432. PMID 29084917. doi:10.1158/1078-0432.CCR-17-2335. Consultado el 2 de noviembre de 2017.
- Trimble, Cornelia L; Morrow, Matthew P; Kraynyak, Kimberly A; Shen, Xuefei; Dallas, Michael; Yan, Jian; Edwards, Lance; Parker, R Lamar et al. (21 de noviembre de 2015). «Safety, efficacy, and immunogenicity of VGX-3100, a therapeutic synthetic DNA vaccine targeting human papillomavirus 16 and 18 E6 and E7 proteins for cervical intraepithelial neoplasia 2/3: a randomised, double-blind, placebo-controlled phase 2b trial». The Lancet 386 (10008): 2078-2088. doi:10.1016/S0140-6736(15)00239-1. Consultado el 25 de octubre de 2017.
- Trimble, Cornelia L.; Morrow, Matthew P.; Kraynyak, Kimberly A.; Shen, Xuefei; Dallas, Michael; Yan, Jian; Edwards, Lance; Parker, R. Lamar et al. (21 de noviembre de 2015). «Safety, efficacy, and immunogenicity of VGX-3100, a therapeutic synthetic DNA vaccine targeting human papillomavirus 16 and 18 E6 and E7 proteins for cervical intraepithelial neoplasia 2/3: a randomised, double-blind, placebo-controlled phase 2b trial». Lancet (London, England) 386 (10008): 2078-2088. ISSN 1474-547X. PMC 4888059. PMID 26386540. doi:10.1016/S0140-6736(15)00239-1. Consultado el 10 de octubre de 2017.
- «Inovio Begins Phase 3 Clinical Trial of VGX-3100 for the Treatment of HPV-Related Cervical Pre-Cancer». ir.inovio.com (en inglés canadiense). Archivado desde el original el 2 de noviembre de 2017. Consultado el 1 de noviembre de 2017.
- Carvajal, Antonio Albarran y; Garza, Alfonso de la; Quiroz, Benitez Jose Cecilio Cruz; Zea, Eduardo Vazquez; Estrada, Ismael Díaz; Fuentez, Ernesto Mendez; Contreras, Mario López; Andrade-Manzano, Alejandro et al. (1 de enero de 2007). «MVA E2 Recombinant Vaccine in the Treatment of Human Papillomavirus Infection in Men Presenting Intraurethral Flat Condyloma». BioDrugs (en inglés) 21 (1): 47-59. ISSN 1173-8804. doi:10.2165/00063030-200721010-00006. Consultado el 7 de octubre de 2017.
- Colegio de Ginecología y Obstetricia de Monterrey, A.C. (12 de julio de 2017), Entrevista al Dr. Ricardo Rosales Ledezma, Vacuna Terapéutica para lesiones VPH, consultado el 7 de octubre de 2017.
- Colegio de Ginecología y Obstetricia de Monterrey, A.C. (7 de julio de 2017), Conferencia Inmunoterapia de lesiones por VPH, Dr. Ricardo Rosales Ledezma, consultado el 7 de octubre de 2017.
Enlaces externos
- Lippman, Abby; Shimmin, Carolyn; Melynk, Ryan; y Boscoe, Madeline (2007): «HPV, vaccines, and gender: policy considerations», artículo de 2007 en el sitio web de la CWHN (Canadian Women’s Health Network). Una perspectiva feminista acerca de la vacuna, con preguntas y precauciones.
- State Update on HPV Vaccine Mandates
- «News and commentary on HPV vaccines», artículo en inglés en el sitio web del Center for Bioethics de la Universidad de Pensilvania.
- The Cervical Cáncer Blog
- Artículo en el sitio web AAR (Australia).
- Advisory Committee on Immunization Practices Minutes
- «HPV fact sheets» artículo en inglés en el sitio web de los CDC (Centros para el Control y la Prevención de Enfermedades).
- CDC STD Human Papillomavirus (HPV) Infection
- CervicalCáncer.gsk.com (sitio web oficial de GSK).
- «Cómo prevenir y tratar el HPV», artículo en el sitio web Consultorio Femenino.
- Data on clinical trials
- FDA Product Approval Information - Licensing Action
- «Cervarix», artículo de presentación en el sitio web GSK (Glaxo Smith & Kline).
- iGardasil.com ("informational" website).
- «HPV and you: girls learn about HPV from the commercials, not the classroom», artículo de Myra Hellerstein y Amanda Thieroff en el periódico The Indypendent.
- «HPV and cervical cáncer», artículo en el sitio web JO Trust, la principal fundación británica contra el cáncer de cérvix.
- «HPV, cervical cáncer, and the new vaccine», artículo en el sitio web KaiserEdu.org.
- «News and reference links», artículo en inglés en el sitio web Medline.
- MedlinePlus on HPV
- [http://www.nytimes.com/2006/06/30/health/30vaccine.html?ex=1309320000&en=73611cb06d9b311d&ei=5090 «Panel unanimously recommends cervical cáncer vaccine for girls 11 and up», artículo en The New York Times del 30 de junio de 2006.
- «Panel unanimously recommends cervical cáncer vaccine for girls 11 and up», artículo de Gardiner Harris, en el periódico The New York Times del 30 de junio de 2006.
- «How a vaccine search ended in triumph», artículo en The New York Times del 29 de agosto de 2006.
- «A cáncer vaccine is born», artículo en el sitio web Rochester.
- UCSB Human Sexuality HPV information page Archivado el 8 de junio de 2007 en Wayback Machine.
- «Women’s health specialists welcome cáncer prevention vaccine», artículo del 18 de julio de 2006 en el sitio web SOGC.
- «Defusing the war over the “promiscuity” vaccine» Archivado el 14 de enero de 2009 en Wayback Machine., artículo en la revista TIME Magazine del 21 de junio de 2006.
- «Vaccine for girls raises thorny issues» (‘la vacuna para niñas despierta espinosas dudas’), artículo en el periódico Washington Post acerca del derecho de las personas a decidir si aplicarse la vacuna.
- «What is HPV», artículo en inglés, con kit de instrumentos del activista.
- «A critical and feminist critique of the hype», artículo en inglés en el sitio web Women's Health Clinic.