Échinomycine
L'échinomycine ou lévomycine[2] ou quinomycine A[2] est un antibiotique polypeptidique cytotoxique contenant deux substituants quinoxaline qui se lie à l'ADN et inhibe la synthèse des ARN[2]. Il s'intercale dans l'ADN sur deux sites spécifiques, bloquant ainsi la fixation du facteur HIF1alpha (hypoxia inducible factor 1 alpha).
| Échinomycine | |

| |
| Identification | |
|---|---|
| Nom UICPA | N-[2,4,12,15,17,25-hexaméthyl-29-méthylsulfanyl-3,6,10,13,16,19,23,26-octaoxo-11,24-di(propan-2-yl)-7-(quinoxaline-2-carbonylamino)-9,22-dioxa-28-thia-2,5,12,15,18,25-hexazabicyclo[12.12.3]nonacosan-20-yl]quinoxaline-2-carboxamide |
| Synonymes |
quinomycine A, lévomycine |
| No CAS | , (lévomycine) |
| No ECHA | 100.164.832 |
| PubChem | 3197 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C51H64N12O12S2 [Isomères] |
| Masse molaire[1] | 1 101,257 ± 0,061 g/mol C 55,62 %, H 5,86 %, N 15,26 %, O 17,43 %, S 5,82 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Biosynthèse
L'échinomycine est synthétisée par une unique peptide-synthétase non ribosomique (PNRs)[3]. L'échinomycine peut être isolée de diverses bactéries telles que Streptomyces lasalienis ou Streptomyces echinatus. Elle appartient à la famille d'antibiotiques quinoxaline qui sont très intéressants parce qu'ils ont de fortes propriétés antibactériennes, anticancéreuses et même une activité antivirale[4].
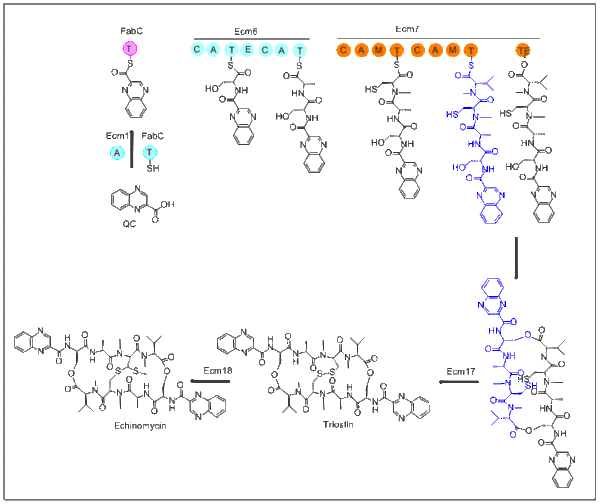
La biosynthèse de l'échinomycine commence par la molécule QC (ci-dessous). Le L-tryptophane est le précurseur de la biosynthèse de QC et cette étape est identique à la première étape de la biosynthèse de la nikkomycine. Après que QC est synthétisé, le domaine d'adénylation contenant Ecm1 active et transfère QC à FabC en utilisant une protéine porteuse d'acyle (ACP) de biosynthèse d'acides gras. Le premier module suivant Ecm6 accepte QC-SFabC en tant que l'unité de démarrage. Emc7 contient un domaine terminal thioestérase qui permet au peptide de dimériser et d'être relâché. Ce produit cyclique va ensuite à Ecm17, une oxydoréductase, qui crée un pont disulfure. La dernière étape de cette biosynthèse transforme la liaison disulfure dans un pont thioacétal. Cette transformation a lieu avec Ecm18, qui est assez similaire à la méthyltransférase dépendante de la S-adénosyl-L-méthionine (en)(SAM)[4].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Echinomycin » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem CID : 3197
- K. Watanabe, H. Oguri, H. Oikawa, Diversification of echinomycin molecular structure by way of chemoenzymatic synthesis and heterologous expression of the engineered echinomycin biosynthetic pathway, Current Opinion in Chemical Biology, 2009, vol. 13(2), pp. 189–196. DOI:10.1016/j.cbpa.2009.02.012, .
- K. Watanabeet al., Total biosynthesis of antitumor nonribosomal peptides in Escherichia coli, Nature chemical biology, 2006, vol. 2(8), pp. 423–428. DOI:10.1038/nchembio803, .
- Portail de la chimie
- Portail de la biochimie
- Portail de la pharmacie