Électrode
Une électrode est un conducteur électronique, ou ionique (ex. : verre) captant ou libérant des électrons[1].
Pour le Pokémon homonyme, voir Électrode.
Les électrodes interviennent dans les systèmes générateurs de courant (comme les piles) et dans les électrolyses, dont le système est récepteur de courant.
On parle aussi d'électrodes pour désigner des composants de certains appareils électriques comme les lampes radio, tube à rayons X, diodes à semi-conducteur. C'est également le cas dans le soudage à l'arc électrique.
Enfin, on parle d'électrode en biologie pour désigner un dispositif conducteur permettant de capter les variations de potentiel électrique chez un organisme vivant.
Types
Les électrodes sont classées en type (ou espèce) d'électrode :
- 1er type : le métal en présence d'un de ses sels en solution (ex. : Cu et Cu2+) ;
- 2e type : le métal en présence d'un de ses sels peu soluble (ex. : Ag et AgCl) ;
- 3e type : le métal est inerte (ex. : Pt) et plonge dans une solution dont les solutés constituent un couple redox (ex. : Fe3+ / Fe2+) ;
- 4e type : les électrodes spécifiques, qui mesurent l'activité d'un ion.
Électrodes pour l'électrolyse
Une électrolyse met en jeu deux électrodes, chacune est à un potentiel différent correspondant au couple rédox mis en jeu. Une réaction d'oxydoréduction forcée (provoquée par le courant) a lieu à chaque électrode :
- l'une est le siège de la réaction de réduction, c'est la cathode (reliée au pôle – du générateur) ; par exemple Cu2+ + 2e− → Cu. Le potentiel de la cathode est d'autant plus inférieur au potentiel de Nernst que le courant qui la traverse est élevé ;
- l'autre est le siège de la réaction d'oxydation, c'est l'anode (reliée au pôle + du générateur) ; par exemple 2Br− → Br2 + 2e−. Le potentiel de l'anode est d'autant plus supérieur au potentiel de Nernst que le courant qui la traverse est élevé.
Les réactions qui se déroulent à chaque électrode mettent en jeu des électrons. Ce ne sont pas pour autant des demi-équation, mais bel et bien des réactions chimiques. C'est l'originalité des électrodes de mettre en jeu des électrons comme réactif ou comme produit.
Selon le sens de circulation conventionnel du courant, le courant continu :
- entre dans l'électrolyseur par l'anode ;
- et sort par la cathode pour retourner au générateur.
Électrodes pour les piles
Une pile électrique est formée de deux compartiments, chacun contenant une électrode. La réaction redox de la pile se déroule par moitié à chacune, qui sont le siège d'une réaction spontanée :
- l'une est le siège de la réaction de réduction, c'est la cathode (pôle + de la pile) ;
- l'autre est le siège de la réaction d'oxydation, c'est l'anode (pôle – de la pile).
On distingue plusieurs catégories d'électrodes (première catégorie, seconde catégorie).
Électrodes en chimie analytique
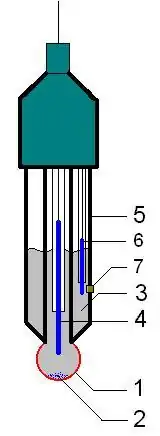
La plupart des méthodes d'analyse dans le domaine de l'électrochimie, électroanalyses, utilisent des électrodes :
- potentiométrie : on mesure la différence de potentiel entre une électrode de mesure (dont le potentiel varie en fonction des espèces en solution) et le potentiel fixe d'une électrode de référence :
- électrode de référence : électrode au calomel saturée ou électrode au sulfate mercureux,
- électrode indicatrice (ou de mesure) : électrode de platine ou d'argent ;
- pH-métrie :
- électrode de référence : électrode au calomel saturée,
- électrode indicatrice (ou de mesure) : électrode à hydrogène, électrode à quinhydrone, électrode d'antimoine et surtout électrode de verre ;
- polarographie : utilise une électrode à goutte de mercure ;
- voltammétrie :
- électrode de référence : électrode au calomel saturée ou électrode au chlorure d'argent,
- électrode de travail : électrode au mercure ou autres métaux solides,
- électrode auxiliaire : sert au passage du courant, en platine ou en carbone.
Électrodes transparentes
Il peut être nécessaire de disposer d'électrodes transparentes, qui font actuellement l'objet de recherches (ex. : polymère contenant des nanofils métalliques (d'argent et/ou de cuivre) et de nanomatériaux carbonés (nanotubes de carbone, oxyde de graphène réduit))[2].
Notes et références
- Définitions lexicographiques et étymologiques de « Électrode » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- J. Idier, Utilisation de nanomatériaux anisotropes pour l'élaboration d'électrodes transparentes conductrices, thèse de doctorat en chimie-physique, université de Bordeaux, 2016.
Articles connexes
- Portail de la chimie
- Portail de la physique