Épingle à cheveux bêta
L'épingle à cheveux bêta (parfois appelée ruban bêta ou unité bêta-bêta) est un motif structurel observée dans la structure secondaire des protéines. Ce motif implique deux brins bêta organisé comme une épingle à cheveux, il est formé de deux brins bêta adjacents dans la structure primaire des protéines, antiparallèles (l'extrémité N-terminale d'un brin est adjacent à l'extrémité C-terminale de l'autre) reliés par une courte boucle de deux à cinq acides aminés. L'épingle à cheveux bêta peut être observée comme un motif isolé dans une protéine ou inséré dans une série de brins formant un feuillet bêta.

Des études structurales réalisées par RMN sur des peptides courts en solution aqueuse ont montré la présence d'épingles à cheveux bêta suggérant que ce type de motif pourrait être une des premières structures formées et pourrait participer au repliement des protéines[1].
Classification
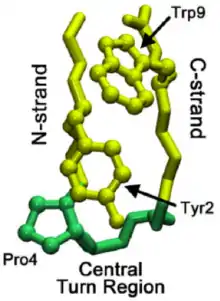
Une première classification des épingles à cheveux β a été proposée, elle est basée sur le nombre d'acides aminés présents dans la boucle et permettait d'obtenir les noms suivants : épingle à cheveux β à un résidu, épingle à cheveux β à deux résidus[3]. Cette classification est cependant ambiguë et incomplète car elle ne donne pas d'information sur le nombre de liaisons hydrogène des acides aminés terminant l'épingle à cheveux. Une autre classification est proposée par Miner-White et Poet[4] qui rangent les épingles à cheveux β en quatre classes. Chacune des classes commence par le plus petit nombre d'acides aminés dans la boucle puis la taille de la boucle augmente en éliminant les liaisons hydrogène du feuillet β.
L'épingle à cheveux β de classe 1 est formée d'une boucle dotée d'un unique acide aminé, avec l'élimination d'une liaison hydrogène dans le feuillet β la boucle est alors formée de trois résidus et appelée épingle à cheveux β secondaire de classe 1 en précisant les acides aminés de la boucle. De la même manière une nouvelle liaison hydrogène peut être rompue pour former une épingle à cheveux β tertiaire à cinq acides aminés. Les épingles à cheveux de classe 2 sont décrites selon la même méthode comme pour les classes 3 et 4.
L'insertion ou la délétion d'acides aminés entraine une restructuration du brin β afin d'éviter une modification trop importante de la structure secondaire, la classe de l'épingle à cheveux β est souvent modifiée dans ce type de mutation. Les mutations les plus courantes restent cependant les substitutions d'acides aminés, une protéine peut ainsi subir une substitution sans modification du motif ou de la fonctionnalité de l'épingle à cheveux β.
Repliement dynamique
L'étude des repliements des micro-domaines comme les épingles à cheveux β peut permettre une meilleure compréhension du repliement général des protéines. Des études ont été réalisées sur un peptide appelé chignolin formé d'un enchainement d'acides aminés similaires à 13 000 motifs d'épingles à cheveux connues pour observer les différentes étapes du repliement[2]. La formation initiale de la boucle du motif permet l'organisation de l'ensemble du peptide.
Dans le cas des repliements des protéines, la boucle du motif en épingle à cheveux β n'est pas systématiquement créée la première. Les premières interactions menant aux structures secondaire peuvent provenir du brin C-terminale et se propager jusque dans la zone de la boucle. Dans certains cas, les interactions entre acides aminés sont trop fortes et la propagation a pour origine la partie N-terminale. Une fois la boucle de l'épingle à cheveux β formée les interactions entre les prolines et les tryptophanes stabilisent le tour empêchant la dénaturation du motif. Les formations de boucle initiée par les structures secondaires issues du N-terminale sont défavorisées par la rigidité de la structure souvent liée à la présence d'une proline limitant les possibilités conformationnelles pour les acides aminés. La formation du motif s'effectue en une microseconde environ. Une fois la boucle formée le maintien du motif peut s'expliquer par des interactions hydrophobes des chaines latérales des acides aminés ou par un mécanisme de glissière.
Épingle à cheveux bêta artificielle
La conception de peptides adoptant une structure en épingle à cheveux β sans l'aide de liaisons métalliques, d'acides aminés inhabituels ou sans formation de pont disulfure permet d'avoir un aperçu de la dynamique des protéines. Contrairement aux hélices α, les épingles à cheveux β ne sont pas stabilisées par un motif régulier de liaison hydrogène. Les premières tentatives ont nécessité entre 20 et 30 acides aminés pour espérer obtenir les brins β et le motif en épingle à cheveux β. L'utilisation de tryptophane en alternance dans la séquence a permis de réduire à douze le nombre d'acides aminés nécessaire à l'obtention du motif. Les chaines latérales des tryptophanes interagissent pour former un motif semblable à une fermeture éclaire permettant la stabilisation du motif en épingle à cheveux β, les autres acides aminés lui permettent de rester soluble dans l'eau. L'étude de la structure RMN de peptide de cette composition montre l'effet stabilisant des interactions entre les anneaux adjacents d'indole des tryptophanes formant la fermeture à glissière (de trpzip)[5].
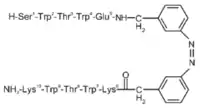
L'ajout de photocommutateurs lors de la synthèse de peptides en épingle à cheveux β (trpzip) a permis de contrôler plus efficacement le repliement des peptides. Les acides aminés impliqués dans la boucle du motif en épingle à cheveux sont remplacés par l'azobenzène. Cette molécule existe sous une conformation cis et une conformation trans, elle passe d'une configuration à l'autre lorsqu'elle est soumise à une lumière de 360 nm. En conformation cis, l'azobenzène permet l'alignement des acides aminés qui lui sont liés comme montré sur la figure ci-contre et permet d'adopter une formation en épingle à cheveux β ; en revanche la conformation trans n'est pas adaptée pour l'obtention du motif. Ce type de molécules peut être utilisé pour l'étude, par spectroscopie d'absorption femtoseconde, de la dynamique conformationnelle des peptidiques[6].
Notes et références
- (en) FJ Blanco, G Rivas et L Serrano, « A short linear peptide that folds into a native stable beta-hairpin in aqueous solution », Nat Struct Biol, vol. 1, no 9, , p. 584–590 (PMID 7634098, DOI 10.1038/nsb0994-584)
- (en) S Enemark, NA Kurniawan et R Rajagopalan, « b-hairpin forms by rolling up from C-terminal: Topological guidance of early folding dynamics », Scientific Reports, vol. 2, , p. 649 (PMID 22970341, PMCID PMC3438464)
- (en) BL Sibanda, TL Blundell et JM Thorton, « Conformations of Beta-Hairpins in Protein Structures », Nature, vol. 316, no 6024, , p. 170-174 (PMID 4010788)
- (en) J Milner-White et R Poet, « Four Classes of Beta-Hairpins in Proteins », Biochemical Journal, vol. 240, no 1, , p. 289-292 (PMID 3827849, PMCID PMC1147409)
- (en) AG Cochran, NJ Skelton et MA Starovasnik, « Tryptophan zippers: stable, monomeric beta -hairpins. », Proceedings of the National Academy of Sciences, vol. 98, no 10, , p. 5578-5583 (PMID 11331745, PMCID PMC33255)
- (en) SL Dong, M Löweneck, TE Schrader, WJ Schreier, W Zinth, L Moroder et C Renner, « A photocontrolled beta-hairpin peptide. », Chemistry - A European Journal, vol. 12, no 4, , p. 1114-1120 (PMID 16294349, DOI 10.1002/chem.200500986)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Beta hairpin » (voir la liste des auteurs).
Voir aussi
Articles connexes
Liens externes
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire