1,2-Diaminocyclohexane
Le 1,2-diaminocyclohexane ou DACH est un composé organique de la famille des diamines consistant en un cycle cyclohexane substitué par deux fonctions amine sur deux atomes de carbone adjacents (vicinaux).
| 1,2-Diaminocyclohexane | |||
| |||
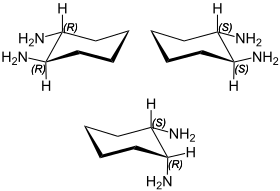
| Structure des énantiomères de la trans-1,2-diaminocyclohexane (en haut): (R,R)-1,2-diaminocyclohexane (à droite) et (S,S)-1,2-diaminocyclohexane (à gauche), et cis-1,2-diaminocyclohexane ou (R,S)-1,2-diaminocyclohexane ou méso-1,2-diaminocyclohexane (en bas) | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 1,2-Diaminocyclohexane | ||
| Synonymes |
DACH |
||
| No CAS | (mélange trans et cis) (racémique trans) (isomère cis ou méso) (énantiomère (R,R)-(–)) (énantiomère (S,S)-(+)) |
||
| No ECHA | 100.010.707 | ||
| No CE | 211-776-7 (mélange) | ||
| No RTECS | GU8749500 (mélange) | ||
| PubChem | 4610 (mélange) 43806 (-) 479307 (+) |
||
| SMILES | |||
| Apparence | Liquide incolore d'odeur ammoniacale[1] | ||
| Propriétés chimiques | |||
| Formule | C6H14N2 [Isomères] |
||
| Masse molaire[2] | 114,188 8 ± 0,006 2 g/mol C 63,11 %, H 12,36 %, N 24,53 %, |
||
| pKa | 11,3 à 20 °C, cc= 5g/l in H2O[1] | ||
| Propriétés physiques | |||
| T° fusion | 2-15 °C[1] 14-15 °C[3] |
||
| T° ébullition | 183 °C à 1013 hPa[1] 92-93 °C à 18 mmHg[4],[5] 79-81 °C à 15 mmHg[3] 104-110 °C à 40 mmHg[6] |
||
| Solubilité | soluble dans l'eau à 20 °C[1] | ||
| Masse volumique | 0,95 g·cm-3 à 20 °C[1] 0,951-0,952 g·cm-3 à 25 °C[3],[5] |
||
| Point d’éclair | 70 °C[4],[1] | ||
| Pression de vapeur saturante | 0,51 hPa à 20 °C, 11,5 hPa à 70 °C, 346,6 hPa à 150 °C[1] 0,4 mmHg à 20 °C[4],[3],[5] |
||
| Propriétés optiques | |||
| Indice de réfraction | = 1,489-1,49[4],[3] | ||
| Pouvoir rotatoire | = −25°, c = 5 in 1 M HCl pour l'énantiomère (R,R)-(-)[7] = +25°, c = 5 in 1 M HCl pour le (S,S)-(+)[6] |
||
| Précautions | |||
| SGH[1],[4] | |||
 |
|||
| Transport[1],[4] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 4,456 mg/kg (souris, oral)[1] | ||
| CL50 | 200 mg/l (Leuciscus idus,48h, DIN38412, p.15)[1] | ||
| LogP | 0,09 (eau/octanol)[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Stéréoisomérie et nomenclature
Les deux groupes amine en position 1,2 font apparaître deux centres stéréogènes dans la molécule de 1,2-diaminocyclohexane. Ce sont les deux atomes de carbone, donc asymétriques, qui portent les amines. Formellement, il devrait donc y avoir 22 = 4 stéréoisomères. Cependant, le 1,2-diaminocyclohexane possède un axe de symétrie d'ordre 2 (C2) passant par le milieu de la liaison entre les deux carbones asymétriques et le milieu de la liaison de l'autre côté du cycle, entre C4 et C5, donc une des deux paires d'énantiomères n'en est pas une car le (1R,2S)-1,2-diaminocyclohexane est identique au (1S,2R)-1,2-diaminocyclohexane ; c'est un composé méso.
Le 1,2-diaminocyclohexane consiste donc en le mélange d'une paire d'énantiomère et du composé méso. Pratiquement, le composé méso est appelé cis-1,2-diaminocyclohexane tandis que le racémique est appelé trans-1,2-diaminocyclohexane et est donc composé des énantiomères (R,R)-(–)-1,2-diaminocyclohexane et (S,S)-(+)-1,2-diaminocyclohexane.
Synthèse
Un mélange de cis et trans-1,2-diaminocyclohexane peut être obtenu par hydrogénation d'o-phénylènediamine.
Le 1,2-diaminocyclohexane peut être aussi obtenu via une réaction de réarrangement de Curtius sur l'acide cyclohexan-1,2-dioïque[8]. Lorsque l'acide trans-1,2-cyclohexane dicarboxylique est utilisé en tant que matériau de départ, les groupes amino dans le produit sont également disposés en position trans. À partir de l'acide cis-1,2-cyclohexanedicarboxylique (acide méso-1,2-cyclohexanedicarboxylique), le cis-1,2-diaminocyclohexane (méso-1,2-diaminocyclohexane) est obtenue de manière analogue.
Les énantiomères du racémique trans peuvent être résolus en utilisant les sels diastéréoisomères qu'ils forment avec de l'acide tartrique optiquement pur[9].
Utilisation
Via des réactions de condensation avec des α,β-dicétones, le 1,2-diaminocyclohexane peut être utilisé pour la synthèse de pyrazines. L'élimination de deux molécules d'eau sur les intermédiaires obtenus par condensation forme des diimines, qui peuvent ensuite être oxydés en pyrazines.
Par condensation avec des acides carboxyliques activés par estérification (estérification de Steglich) ou des chlorures d'acyle, des diamides peuvent être préparés. Cette réaction est utilisée par exemple dans la synthèse des ligands de Trost[10],[11].

De la même façon, DACH peut aussi conduire avec deux équivalents d'un dérivé du salicylaldéhyde à un dérivé du salen[12]. Ces ligands tétradentés forment aussi des complexes de cobalt II ou de manganèse III[9], qui sont utilisés comme transporteurs d'oxygène, par exemple, dans des époxydations de Jacobsen.
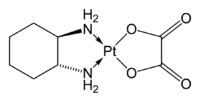
Enfin, le 1,2-diaminocyclohexane peut être utilisé directement comme ligand bidenté en chimie des complexes métalliques. Ainsi l'oxaliplatine, figuré ci-dessous, est un médicament anti-cancéreux.
Notes et références
- « Fiche 1,2-Diaminocyclohexane », Merck [PDF].
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé (±)-trans-1,2-Diaminocyclohexane 99%.
- Fiche Sigma-Aldrich du composé 1,2-Diaminocyclohexane, mixture of cis and trans, 99%.
- Fiche Sigma-Aldrich du composé cis-1,2-Diaminocyclohexane 97%.
- Fiche Sigma-Aldrich du composé (1S,2S)-(+)-1,2-Diaminocyclohexane 98%.
- Fiche Sigma-Aldrich du composé (1R,2R)-(−)-1,2-Diaminocyclohexane 98%, ee=99%.
- Heinrich Otto Wieland, Otto Schlichting, Werner von Langsdorff, Hoppe-Seyler’s Zeitschrift für physiologische Chemie, 1926, vol. 161, p. 76. (ISSN 0018-4888).
- Jay F. Larrow and Eric N. Jacobsen, (R,R)-N,N'-Bis(3,5-di-tert-butylsalicylidene)-1,2-cyclohexanediamino manganese(III) chloride, a highly enantioselective epoxidation catalyst., Org. Synth., 2004, Coll. vol. 10, p. 96.
- B. M. Trost, et al., Acc. Chem. Res., 2006, vol. 39, p. 747.
- B. M. Trost, J. Org. Chem., 2004, vol. 69, p. 5813-5837.
- Konstantin P. Bryliakov, Evgenij P. Talsi, Titanium-Salan-Catalyzed Asymmetric Oxidation of Sulfides and Kinetic Resolution of Sulfoxides with H2O2 as the Oxidant, European Journal of Organic Chemistry, 2008, vol. 16, p. 3369-3376. DOI:10.1002/ejoc.200800277 .
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « trans-1,2-Diaminocyclohexane » (voir la liste des auteurs) et en allemand « 1,2-Diaminocyclohexan » (voir la liste des auteurs).
- Portail de la chimie
