1,3-Diméthyl-2-imidazolidinone
La 1,3-diméthyl-2-imidazolidinone, ou DMI, est une urée cyclique à noyau imidazolidine homologue de la diméthylpropylène urée (DMPU). Elle se présente comme un liquide incolore hygroscopique à l'odeur caractéristique, difficilement inflammable, entièrement miscible avec l'eau. Elle est utilisée comme solvant aprotique à point d'ébullition élevé (de 224 à 226 °C) fortement polaire très stable à la fois chimiquement et thermiquement, ce qui en fait un milieu réactionnel intéressant pour les réactions devant se dérouler à des températures supérieures à 180 °C[4]. Elle est miscible avec pratiquement tous les solvants organiques et, en raison de sa constante diélectrique (37,60 F m−1) et de son moment dipolaire (4,05 à 4,09 D) élevés[5], dissout de nombreux composés organiques et minéraux[6]. Elle peut donc être utilisée à la place de l'hexaméthylphosphoramide (HMPA), qui est cancérogène[7]. Elle peut également être utilisée en remplacement du N,N-diméthylformamide (CH3)2NCHO (DMF) ou du diméthylsulfoxyde (CH3)2SO (DMSO) en prévention d'une plus grande toxicité ou d'une moindre stabilité thermique ou chimique.
| 1,3-Diméthyl-2-imidazolidinone | |
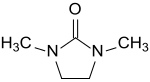
| |
| Structure de la 1,3-diméthyl-2-imidazolidinone | |
| Identification | |
|---|---|
| Nom UICPA | 1,3-diméthylimidazolidin-2-one |
| No CAS | |
| No ECHA | 100.001.187 |
| No CE | 201-304-8 |
| No RTECS | NJ0660000 |
| PubChem | 6661 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore hygroscopique à l'odeur caractéristique[1] |
| Propriétés chimiques | |
| Formule | C5H10N2O |
| Masse molaire[2] | 114,145 7 ± 0,005 4 g/mol C 52,61 %, H 8,83 %, N 24,54 %, O 14,02 %, |
| Propriétés physiques | |
| T° fusion | 8 °C[1] |
| T° ébullition | 224 à 226 °C[1] |
| Miscibilité | entièrement miscible avec l'eau[1] |
| Masse volumique | 1,056 g·cm-3[1] à 20 °C |
| T° d'auto-inflammation | 305 °C[1] |
| Point d’éclair | 95 °C[1] |
| Limites d’explosivité dans l’air | 1,3 % et 8,4 % en volume[1] |
| Pression de vapeur saturante | 20 Pa[1] à 25 °C |
| Précautions | |
| SGH[1] | |
   Danger |
|
| NFPA 704[3] | |
| Écotoxicologie | |
| DL50 | > 300 à 2 000 mg·kg-1[1] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
Production
La 1,3-diméthyl-2-imidazolidinone est produite industriellement en faisant réagir du phosgène COCl2 avec la 1,2-diméthyléthylènediamine (DMEDA)[8] :
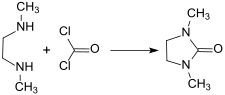
Il est possible d'obtenir un produit avec une pureté de 99,5 % et un rendement de 92,1 % en ajustant finement les paramètres réactionnels tels que le pH (maintenu à 7,3), la température et le dosages des réactifs. Le phosgène, toxique, peut également être remplacé par du dioxyde de carbone[6] CO2 ou de l'urée OC(NH2)2 comme sources de carbonyle tout en maintenant une grande pureté et un bon rendement[4] :
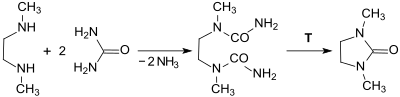
Le produit intermédiaire subit une décomposition thermique dans la 1,3-diméthyl-2-imidazolidinone, qui agit comme solvant à point d'ébullition élevé, de sorte que cette réaction fait partie du processus de production dans rupture de processus en assurant un produit de très grande pureté (plus de 99,9 %) avec un très bon rendement (98 %). La pureté de la 1,3-diméthyl-2-imidazolidinone obtenue dépend fortement de celle de la 1,2-diméthyléthylènediamine utilisée au départ, qui contient souvent des sous-produits ayant des points d'ébullition très voisins.
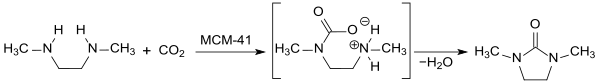
La 1,2-diméthyl-2-imidazolidinone a été proposée comme « puits de carbone » en faisant réagir le dioxyde de carbone supercritique scCO2 avec la 1,2-diméthyléthylènediamine en présence de silicates mésoporeux de type MCM-41 à 300 °C sous 16 MPa dans un processus continu de manière quantitative[9] ; les conditions de réactions sont cependant consommatrices d'énergie et ne sont pas celles qui sont privilégiées pour un procédé respectueux de l'environnement.
Applications
Comme solvant
Stable en présence d'acides et de bases même aux températures élevées, la 1,3-diméthyl-2-imidazolidinone convient comme solvant pour alcalis qui, lorsqu'ils sont mélangés avec des tensioactifs et des alcools, sont de bons agents de nettoyage pour les surfaces métalliques ou en verre. Elle forme des solutions ou des dispersions stables avec les colorants et les pigments qui améliorent leur stabilité lors du stockage ainsi que leurs propriétés d'application sur les matériaux. Une solution de naphtaléniure de sodium Na+[C10H8]− dans la 1,3-diméthyl-2-imidazolidinone convient pour la gravure de surfaces en polytétrafluoroéthylène (PTFE) pour un meilleur mouillage avec des adhésifs ou une meilleure connexion avec des surfaces métalliques.
Comme d'autres amides liquides tels que le N,N-diméthylformamide (DMF), la N-méthyl-2-pyrrolidone (NMP) ou la diméthylpropylène urée (DMPU), la 1,3-diméthyl-2-imidazolidinone peut être utilisée comme décapant, et généralement avec d'autres amines et solvants polaires comme la diglycolamine (de) HOCH2CH2OCH2CH2NH2 pour traiter des résines photosensibles.
Comme milieu réactionnel
La 1,3-diméthyl-2-imidazolidinone (notée DMEU dans la réaction ci-dessous) a servi de solvant avec un catalyseur ruthénium-rhodium, de l'imidazole comme ligand et de l'iodure de lithium LiI comme promoteur a permis la synthèse de l'acide acétique CH3COOH par hydrocarboxylation du méthanol CH3OH avec du CO2 et de l'hydrogène H2 à 200 °C[10] :
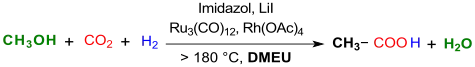
Cette méthode, qui emploie des catalyseurs coûteux — dodécacarbonyle de triruthénium Ru3(CO)12 et acétate de rhodium(II) Rh2(CH3COO)4 — pour un rendement d'à peine 70 % est cependant loin d'être aussi compétitive que le procédé Monsanto de carbonylation du méthanol.
L'alcool 3-phénoxybenzylique (de), précurseur important des insecticides pyréthrinoïdes, peut être produit avec un rendement 88 % par réaction d'Ullmann sur de l'alcool 3-hydroxybenzylique (de) avec du chlorobenzène C6H5Cl dans la 1,3-diméthyl-2-imidazolidinone en présence de carbonate de potassium K2CO3 et de quantités catalytiques de 8-hydroxyquinoléine avec du chlorure de cuivre(I) CuCl, alors que les mêmes conditions de réaction ne donnent qu'un rendement 21 % dans le DMF et de 58 % dans le DMSO[11].
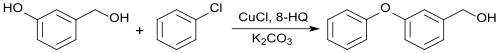
L'échange d'halogènes sous forme d'une substitution nucléophile aromatique sur des composés aromatiques pauvres en lectrons, comme le 4-chloronenzonitrile, est possible avec le fluorure de potassium dans la 1,3-diméthyl-2-imidazolidinone à 290 °C dans un réacteur étanche sous pression avec une rendement de 91 % en 4-fluorobenzonitrile (de)[12].
L'acide risédronique et l'acide zolédronique, deux bisphosphonates utilisés principalement contre l'ostéoporose, peuvent être produits avec de bons rendements en solution homogène dans la 1,3-diméthyl-2-imidazolidinone[13] ; ci-dessous la synthèse de l'acide zolédronique :
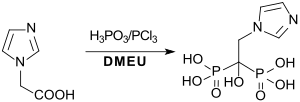
Notes et références
- Entrée « 1,3-Dimethyl-2-imidazolidinone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 mars 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé 1,3-Dimethyl-2-imidazolidinone, 98% », sur Alfa Aesar (consulté le ).
- (en) Hideki Mizuta, Masazumi Takaoka et Teruyuki Nagata pour Mitsui Chemicals Inc, Brevet U.S. 5872260 : High purity 1,3-dialkyl-2-imidazolidinone and preparation process of same, déposé le 5 août 1996, publié le 16 février 1999, sur Google Patents.
- (en) Joseph Rosenfarb, Hugh L. Huffman Jr. et Joseph A. Caruso, « Dielectric constants, viscosities, and related physical properties of several substituted liquid ureas at various temperatures », Journal of Chemical and Engineering Data, vol. 21, no 2, , p. 150-153 (DOI 10.1021/je60069a034, lire en ligne)
- (de) Barbara J. Barker, Joseph Rosenfarb et Joseph A. Caruso, « Harnstoffe als Lösungsmittel in der chemischen Forschung », Angewandte Chemie, vol. 91, no 7, , p. 560-564 (DOI 10.1002/ange.19790910707, lire en ligne)
- (en) Chi -Chu Lo et Pei -Min Chao, « Replacement of carcinogenic solvent HMPA by DMI in insect sex pheromone synthesis », Journal of Chemical Ecology, vol. 16, , p. 3245-3253 (PMID 24263426, DOI 10.1007/BF00982095, lire en ligne)
- (en) Teruyuki Nagata, Nobuyuki Kajimoto, Masaru Wada, Hitoshi Nakayama et Tadao Yamada pour Mitsui Chemicals Inc, Brevet U.S. 4668793 : Process for producing 1,3-dimethyl-2-imidazolidinone, déposé le 1er novembre 1984, publié le 26 mai 1987, sur Google Patents.
- (en) Tsunetake Seki, Yoshiaki Kokubo, Shinichiro Ichikawa, Tomoyuki Suzuki, Yoshihito Kayakia et Takao Ikariya*a, « Mesoporous silica-catalysed continuous chemical fixation of CO2 with N,N′-dimethylethylenediamine in supercritical CO2: the efficient synthesis of 1,3-dimethyl-2-imidazolidinone », Chemical Communications, vol. 2009, no 3, , p. 349-351 (DOI 10.1039/B817879H, lire en ligne)
- (en) Qingli Qian, Jingjing Zhang, Meng Cui et Buxing Han, « Synthesis of acetic acid via methanol hydrocarboxylation with CO2 and H2 », Nature Communications, vol. 7, , article no 11481 (PMID 27165850, PMCID 4865843, DOI 10.1038/ncomms11481, Bibcode 2016NatCo...711481Q, lire en ligne)
- (en) OI Ryu, Shimakawa Chitoshi et Takenaka Shinji, « Ullmann Ether Synthesis in DMI. Preparation of m-Phenoxybenzyl Alcohol », Chemistry Letters, vol. 17, no 5, , p. 899-900 (DOI 10.1246/cl.1988.899, lire en ligne)
- (en) Hiroshi Suzuki et Yoshikazu Kimura, « Synthesis of 3,4-difluorobenzonitrile and monofluorobenzonitriles by means of halogen-exchange fluorination », Journal of Fluorine Chemistry, vol. 52, no 3, , p. 341-351 (DOI 10.1016/S0022-1139(00)80348-6, lire en ligne)
- (en) Joana Baptista et Zita Mendes, Brevet U.S. 20090326227A1 : Process for the preparation of biphosphonic acids and salts thereof, déposé le 6 novembre 2006, publié le 31 décembre 2009, sur Google Patents.
- Portail de la chimie
