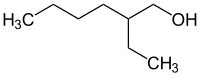
2-Éthyl-1-hexanol
Le 2-éthylhexanol, est un alcool gras, un composé organique utilisé dans la fabrication d'une variété de produits. Il fait partie des alcools de synthèse les plus importants : on en produit 2 × 106 tonnes par année dans le monde. Il se présente sous la forme d'un liquide clair et incolore qui est pratiquement insoluble dans l'eau, mais facilement soluble dans la plupart des solvants organiques.
| 2-Éthyl-1-hexanol | |
| |
| Identification | |
|---|---|
| Nom UICPA | 2-éthyl-1-hexanol |
| Synonymes |
2-éthylhexanol |
| No CAS | (racémique) (R) (S) |
| No ECHA | 100.002.941 |
| No CE | 203-234-3 |
| FEMA | 3151 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H18O [Isomères] |
| Masse molaire[1] | 130,227 9 ± 0,008 g/mol C 73,78 %, H 13,93 %, O 12,29 %, |
| Propriétés physiques | |
| T° fusion | −70 °C |
| T° ébullition | 184,6 °C |
| Solubilité | 880 mg l−1 (eau, 25 °C) |
| Masse volumique | g cm−3 |
| Écotoxicologie | |
| Seuil de l’odorat | bas : 0,07 ppm haut : 0,13 ppm[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le 2-éthylhexanol peut facilement être converti en esters qui ont une variété d'usages. L'utilisation la plus répandue est la fabrication du diester bis(2-éthylhexyl) phtalate (DEHP), un plastifiant. Parce que c'est un alcool gras, les esters du 2-éthylhexanol tendent à avoir des propriétés émollientes. L'octocrylène, un filtre ultraviolet, contient un ester 2-éthylhexyle à cet effet. Il est également utilisé comme solvant peu volatil.
La molécule de 2-éthylhexanol est chirale car l'atome de carbone C2 portant le radical éthyle est stéreogène. Le 2-éthylhexanol se présente donc sous la forme de deux énantiomères R et S.
Il est à noter que le terme isooctanol n'est pas un synonyme du 2-éthylhexanol dans tous les systèmes de nomenclature chimique. D'après le Chemical Abstracts Service, l'isooctanol (CAS ) renvoie à un isomère de l'octanol, 6-méthylheptan-1-ol.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « 2-Ethylhexanol », sur hazmap.nlm.nih.gov (consulté le )
- Portail de la chimie