2-Méthylbut-2-ène
Le 2-méthylbut-2-ène ou 2-méthyl-2-butène (ou encore amylène) est un hydrocarbure alcénique de formule semi-développée CH3-CH=C(CH3)2. C'est un isomère du pentène.
| 2-Méthylbut-2-ène | |
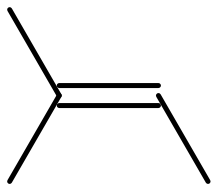  |
|
| Identification | |
|---|---|
| Nom UICPA | 2-méthylbut-2-ène |
| Synonymes |
triméthyléthylène |
| No CAS | |
| No ECHA | 100.007.416 |
| No CE | 208-156-3 |
| PubChem | 10553 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore |
| Propriétés chimiques | |
| Formule | C5H10 [Isomères] |
| Masse molaire[1] | 70,132 9 ± 0,004 7 g/mol C 85,63 %, H 14,37 %, |
| Propriétés physiques | |
| T° fusion | −134 °C[2],[3] |
| T° ébullition | 35-38 °C[2] 38,5 °C[3] |
| Solubilité | 0,19 g·l-1 (eau,25 °C) [4] |
| Masse volumique | 0,662 g·cm-3 à 25 °C[2] |
| T° d'auto-inflammation | 290 °C [4] |
| Point d’éclair | −45 °C[4] |
| Limites d’explosivité dans l’air | 1–9 %vol [4] |
| Pression de vapeur saturante | 7,66 psi à 20 °C; 25,09 psi à 55 °C[2] 468 mmHg à 25 °C[3] |
| Propriétés optiques | |
| Indice de réfraction | = 1,385[2] |
| Précautions | |
| SGH[4] | |
    |
|
| Transport[4] | |
| Écotoxicologie | |
| LogP | 2,67 [4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
Total et Gevo ont développé un procédé catalytique pour transformer les alcools de fusel en amylène[5].
Utilisation
Le 2-méthylbut-2-ène est utilisé pour piéger l'acide hypochloreux généré dans l'oxydation de Pinnick[6].
Le 2-méthylbut-2-ène peut former un nitrosate qui est une huile bleue qui forme deux types de cristaux de dimères, des cubes et des aiguilles[7].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 2-Methyl-2-butene chez Sigma-Aldrich.
- (en) « 2-Méthylbut-2-ène », sur ChemIDplus
- Entrée « 2-Methyl-2-butene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 11 novembre 2010 (JavaScript nécessaire)
- Françoise de Vaugelas, « Isoamylène biosourcé : Total Cray Valley et Gevo poursuivent leur collaboration », sur formuleverte.com, (consulté le ).
- (en) László Kürti et Barbara Czakó, Strategic Applications of Named Reactions in Organic Synthesis : Background and Detailed Mechanisms, Amsterdam, Elsevier Academic press, , 758 p. (ISBN 0-12-429785-4), p. 354
- C. A. Taylor, Wm. H. Rinkebach, Stereo-isomeric forms of bis(triméthylethylene nitrosate), J. Am. Chem. Soc., 1926, vol. 48(6), pp. 1684–1687. DOI:10.1021/ja01417a034
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.
