3-Nitroaniline
La 3-nitroaniline, ou 1-amino-3-nitrobenzène, est un solide stable non volatil couramment utilisé comme matière première de certaines teintures[2]. C'est un dérivé de l'aniline portant une fonction nitro en position 3. C'est donc l'un des trois isomères de la nitroaniline, le composé méta, les deux autres étant la 2-nitroaniline (ortho) et la 4-nitroaniline (para).
| 3-Nitroaniline | |
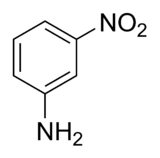
| |
| Identification | |
|---|---|
| Nom UICPA | 3-nitroaniline |
| Nom systématique | 3-nitrobenzenamine |
| Synonymes |
m-nitroaniline, meta-nitroaniline, 1-amino-3-nitrobenzène |
| No CAS | |
| No ECHA | 100.002.481 |
| No CE | 202-729-1 |
| No RTECS | BY6825000 |
| PubChem | |
| Apparence | cristaux solides jaunes |
| Propriétés chimiques | |
| Formule | C6H6N2O2 [Isomères] |
| Masse molaire[1] | 138,124 ± 0,006 2 g/mol C 52,17 %, H 4,38 %, N 20,28 %, O 23,17 %, |
| pKa | 2,466 |
| Propriétés physiques | |
| T° fusion | 114 °C |
| T° ébullition | 306 °C |
| Solubilité | 0,89 g/l (25 °C) |
| Masse volumique | 1,4 g/cm3 |
| Pression de vapeur saturante | 0,005 Pa (25 °C) |
| Précautions | |
| SGH | |
  Danger |
|
| Écotoxicologie | |
| DL50 | 308 mg·kg−1 (souris, oral) |
| LogP | 1,37 |
| Composés apparentés | |
| Isomère(s) | 2-Nitroaniline 4-Nitroaniline |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Ce composé organique, présent à température ambiante sous la forme de cristaux jaunes, est stable dans les solutions aqueuses, qu'elles soient neutres, acides ou alcalines. Il est légèrement soluble dans l'eau et très soluble dans tout solvant organique (éthanol, éther, chloroforme). Il est par ailleurs qualifié de « difficilement biodégradable » avec un « faible potentiel de bioaccumulation ».
La 3-nitroaniline est toxique et son exposition peut provoquer une augmentation de la méthémoglobine dans le sang, une peau et des ongles bleuâtres, des maux de tête ainsi que des malaises et des vomissements.
Synthèse
Il peut être synthétisé par la nitration du benzamide suivie du réarrangement de Hofmann du 3-nitrobenzamide alors formé. La synthèse consiste ensuite à traiter le 3-nitrobenzamide avec de l'hypobromite de sodium ou de l'hypochlorite de sodium pour transformer le groupement amide en amine.
Le composé est aussi préparé à partir de composés organiques tels que le m-nitrophénol et la tétranitroaniline.
Utilisation
La m-nitroaniline est utilisée dans la préparation de composés nécessaires à la fabrication de colorants azoïques. Son acétylation et sa réduction conduisent par exemple à la formation de 3-aminoacétanilide.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « UNEP PDF on m-Nitroaniline » [archive du ] (consulté le )
- Portail de la chimie