4-Nitrophénol
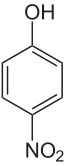
Le 4-nitrophénol, paranitrophénol, p-nitrophénol ou 4-hydroxynitrobenzène, est un composé aromatique de formule moléculaire C6H5NO3. Constitué d'un cycle benzénique substitué par un groupe nitro et un groupe hydroxyle (phénol), c'est l'un des trois isomères du nitrophénol, le composé « para ».
| 4-Nitrophénol | |
  |
|
| Structure du 4-nitrophénol | |
| Identification | |
|---|---|
| Nom UICPA | 4-Nitrophénol |
| Synonymes |
4-Hydroxynitrobenzène Para-nitrophénol |
| No CAS | |
| No ECHA | 100.002.556 |
| No CE | 202-811-7 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores à jaune pâle, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
| Formule | C6H5NO3 [Isomères] |
| Masse molaire[2] | 139,108 8 ± 0,006 3 g/mol C 51,8 %, H 3,62 %, N 10,07 %, O 34,5 %, |
| Propriétés physiques | |
| T° fusion | 111 à 116 °C[1] |
| T° ébullition | (décomposition) : 279 °C[1] |
| Solubilité | dans l'eau à 25 °C : 12,4 g·l-1[1] |
| Masse volumique | 1,5 g·cm-3[1] |
| Point d’éclair | 169 °C[1] |
| Pression de vapeur saturante | à 20 °C : 0,003 2 Pa[1] |
| Précautions | |
| SGH[3] | |
  Attention |
|
| NFPA 704 | |
| Transport | |
| Écotoxicologie | |
| LogP | 1,91[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Le 4-nitrophénol possède deux polymorphes à l'état cristallin. La forme alpha est incolore, instable à température ambiante et photochimiquement stable. La forme beta est jaune, stable à température ambiante et vire peu à peu au rouge à la lumière. On trouve généralement le 4-nitrophénol sous un mélange de ces deux formes.
En solution, le 4-nitrophénol a une constante de dissociation (pKa) de 7,08 à 22 °C. La couleur de la solution dépend fortement du pH: en milieu acide, la solution est incolore; en milieu basique, elle devient jaune vif. Ce changement de couleur rend ce composé intéressant pour une utilisation en tant qu'indicateur de pH.
Utilisations
On considère que la dégradation à l'air du 4-nitrophénol dans un milieu clos n'est pas bonne. La bioaccumulation de ce composé n'arrive que peu fréquemment. Il sert principalement comme précurseur pour la synthèse de la phénétidine et de l'acétophénétidine, d'indicateur et de matière première pour fongicides. C'est également un intermédiaire de synthèse et un produit de dégradation du paracétamol.
Dans la synthèse de peptides, les esters carboxyliques dérivés du 4-nitrophénol peuvent servir d'activant. Les propriétés spectrophotométriques du 4-nitrophénol (absorption de la lumière ultra-violette à 310 nm[5]) et de sa forme anionique, présente en milieu basique (4-nitrophénate : absorption dans le spectre visible à 405 nm) font également de ces esters des substrats de choix pour les études de cinétique enzymatique[6].
Toxicité
Le 4-nitrophénol est irritant pour les yeux, la peau et le système respiratoire et peut causer des inflammations. Il a des interactions avec le sang et forme de la méthémoglobine qui est responsable de la méthémoglobinémie, qui peut causer des cyanoses et des pertes de connaissance. Lorsqu'il est ingéré, il cause douleurs abdominales et vomissements. Un contact prolongé avec la peau peut créer une réponse allergique. Les effets génotoxiques et cancérigènes du 4-nitrophénol n'ont pas été étudiés.
Références
- p - NITROPHENOL, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Entrée du numéro CAS « 100-02-7 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript nécessaire)
- (en) Pubchem, « P-Nitrophenol », sur pubchem.ncbi.nlm.nih.gov (consulté le )
- (en) J. Anderson, T. Byrne, K. J. Woelfel et J. E. Meany, « The Hydrolysis of p-Nitrophenyl Acetate: A Versatile Reaction To Study Enzyme Kinetics », Journal of Chemical Education, vol. 71, no 8, , p. 715 (ISSN 0021-9584 et 1938-1328, DOI 10.1021/ed071p715, lire en ligne, consulté le )
- Portail de la chimie

