Acétanilide
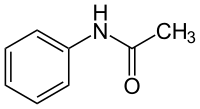
L'acétanilide, aussi appelé acétylaniline ou acétylaminobenzène, est une molécule organique de formule C8H9NO. C'est le précurseur de nombreuses drogues, colorants et autres composés dans la synthèse chimique. Autrefois utilisé comme analgésique et antipyrétique, il est souvent responsable de méthémoglobinémie mortelle. C'est un stabilisant du peroxyde d'hydrogène et des enduits cellulosiques. Il est utilisé dans la fabrication de produits pharmaceutiques comme le paracétamol. Il se présente sous la forme de cristaux blancs et brillants.
| Acétanilide | |
| |
| Identification | |
|---|---|
| Nom UICPA | N-phényléthanamide |
| Synonymes |
N-phénylacétamide |
| No CAS | |
| No ECHA | 100.002.864 |
| No CE | 203-150-7 |
| PubChem | 904 |
| ChEBI | 28884 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs inodores |
| Propriétés chimiques | |
| Formule | C8H9NO [Isomères] |
| Masse molaire[1] | 135,163 2 ± 0,007 5 g/mol C 71,09 %, H 6,71 %, N 10,36 %, O 11,84 %, |
| Propriétés physiques | |
| T° fusion | 114,3 °C [2] |
| T° ébullition | 304 °C [2] |
| Masse volumique | 1,219 0 g·cm-3 à 15 °C [2] |
| Thermochimie | |
| Cp | |
| Précautions | |
| SGH[4] | |
 Attention |
|
| SIMDUT[5] | |
Produit non contrôlé |
|
| NFPA 704 | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physico-chimiques
L'acétanilide est soluble dans l'eau chaude. Ce composé, stable dans les conditions normales, devient autoinflammable lorsque la température atteint 545 °C. Il se présente sous forme de cristaux de couleur blanche lorsque le produit est pur.
Production et synthèse
On prépare l'acétanilide en faisant réagir l'anhydride acétique, soit avec l'aniline, soit avec le chlorure de phénylammonium (en).
Utilisation
Les domaines d'utilisation de l'acétanilide sont les suivants :
- inhibiteur pour le peroxyde d'hydrogène et stabilisateur des esters de cellulose ;
- intermédiaire dans la synthèse du caoutchouc ;
- synthèse du camphre ;
- précurseur dans la synthèse de la pénicilline, de la sulfanilamide et autres produits pharmaceutiques ;
- développement photographique (au XIXe siècle).
En outre, l’acétanilide a des propriétés analgésiques et réduit la fièvre. Elle se classe dans la même catégorie de médicaments que le paracétamol. Elle est souvent prescrite à de nombreux patients et on la trouve dans la plupart des pharmacies. En 1948, Julius Axelrod et Bernard Brodie ont découvert que l'acétanilide est beaucoup plus toxique dans ses utilisations que les autres médicaments, endommageant notamment le foie et les reins.
Découverte
L'acétanilide a été découvert en 1852 par Charles Gerhardt[6].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « acetanilide » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) W. M. Haynes, CRC Handbook of chemistry and physics, Boca Raton, CRC Press/Taylor and Francis, , 91e éd., 2610 p. (ISBN 978-143982-077-3), p. 3-4
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-859-4)
- (en) « Acetanilide », sur European Chemicals Agency (ECHA) (consulté le )
- « Acétanilide » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Pierre de Menten, Dictionnaire de chimie : Une approche étymologique et historique, De Boeck, , 395 p. (ISBN 978-2-8041-8175-8, lire en ligne), p.17
