Acétonitrile
L'acétonitrile, ou cyanure de méthyle, est un composé chimique de formule CH3CN. Ce liquide incolore, d'odeur sucrée, est le nitrile organique le plus simple, et très souvent utilisé en tant que solvant.
| Acétonitrile | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acétonitrile[1] | |
| Nom systématique | éthanenitrile[1] | |
| Synonymes |
cyanure de méthyle |
|
| No CAS | ||
| No ECHA | 100.000.760 | |
| No CE | 200-835-2 | |
| No RTECS | AL7700000 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, d'odeur caractéristique[2] | |
| Propriétés chimiques | ||
| Formule | C2H3N [Isomères] |
|
| Masse molaire[3] | 41,051 9 ± 0,002 g/mol C 58,51 %, H 7,37 %, N 34,12 %, |
|
| Moment dipolaire | 3,925 19 D [4] | |
| Diamètre moléculaire | 0,436 nm [5] | |
| Propriétés physiques | ||
| T° fusion | −46 °C[2] | |
| T° ébullition | 82 °C[2];81,6 °C (760 mmHg)[6] | |
| Solubilité | Miscible avec l'acétone, l'acétate d'éthyle, l'acétate de méthyle, le benzène, le chloroforme, le chlorure d'éthylène, l'eau, l'éthanol, l'éther diéthylique, le méthanol, les solutions d'acétamide, le tétrachlorure de carbone, de nombreux hydrocarbures insaturés; immiscible avec les hydrocarbures saturés[6] | |
| Paramètre de solubilité δ | 24,3 MPa1/2 (25 °C)[7] | |
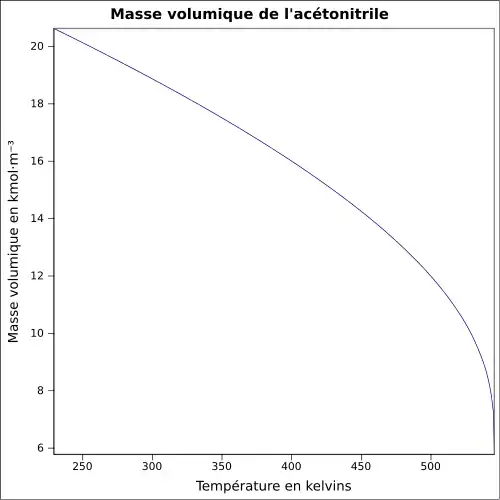
| Masse volumique | 0,8 g·cm-3[2]
|
|
| T° d'auto-inflammation | 524 °C[2] | |
| Point d’éclair | 12,8 °C (coupelle fermée)[2] | |
| Limites d’explosivité dans l’air | 3,0–16 %vol[2] | |
| Pression de vapeur saturante | à 20 °C : 9,7 kPa[2]
|
|
| Viscosité dynamique | 0.345 cP à 25 °C | |
| Point critique | 48,3 bar, 274,75 °C [9] | |
| Thermochimie | ||
| Cp | ||
| PCS | 1 247,2 kJ·mol-1 (25 °C, liquide)[11] | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 12,20 ± 0,01 eV (gaz)[12] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,341 [5] | |
| Précautions | ||
| SGH[13] | ||
  Danger |
||
| SIMDUT[14] | ||
  B2, D1A, D2B, |
||
| NFPA 704 | ||
| Transport[15] | ||
| Écotoxicologie | ||
| LogP | -0,3[2] | |
| Seuil de l’odorat | bas : 40 ppm haut : 1 161 ppm[16] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Production et applications industrielles
L'acétonitrile est obtenu comme sous-produit de la production de l'acrylonitrile, c'est pourquoi la tendance à la production d'acétonitrile suit généralement celle de l'acrylonitrile. Les plus grands producteurs de cette molécule aux États-Unis sont INEOS, DuPont, J.T. Baker Chemical, et Sterling Chemicals. En 1992, 14 700 tonnes d'acetonitrile ont été produits aux États-Unis. En 2008, la crise économique ayant entrainé une baisse soudaine de la demande en fibres et résines acryliques, la production d'acrylonitrile et d'acétonitrile a chuté et le prix de l'acétonitrile a été multiplié par 15 en quelques mois[17]. L'acétonitrile est utilisé comme solvant, notamment dans l'industrie pharmaceutique, mais également comme intermédiaire réactionnel dans la production de bon nombre de substances chimiques des pesticides aux parfums.
Usages en laboratoire
C'est un solvant de choix pour tester une réaction chimique inconnue. Il est polaire, et son domaine liquide est assez étendu ce qui le rend commode. Il dissout une large gamme de composés sans encombre, conséquemment à la présence de protons non acides. L'acétone présente les mêmes propriétés mais elle est plus acide et plus réactive envers les bases et les nucléophiles. En chimie inorganique, l'acétonitrile est très employé comme ligand, abrégé MeCN. On l'utilise par exemple sous la forme PdCl2(MeCN)2 préparé en chauffant à reflux du dichlorure de palladium dans l'acétonitrile. C'est un solvant commun en voltampérométrie cyclique en raison de sa constante diélectrique relativement élevée. L'acétonitrile est aussi souvent utilisée en chromatographie en phase liquide, où il sert de phase mobile pour la séparation de molécules.
Précautions
Il est nocif et inflammable. Il peut pénétrer par voie orale, cutanée ou par inhalation. Il est métabolisé en acide cyanhydrique et thiocyanate.
Détection dans des disques circumstellaires
En , des astronomes utilisant ALMA annoncent la détection de grandes quantités d'acétonitrile dans le disque protoplanétaire entourant la jeune étoile MWC 480.
Liens externes
Notes et références
- Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book), Cambridge, The Royal Society of Chemistry, (ISBN 978-0-85404-182-4, DOI 10.1039/9781849733069-FP001), p. 902
- ACETONITRILE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- « ACETONITRILE » dans la base de données Hazardous Substances Data Bank, consulté le 16 juillet 2012
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Fiche Sigma-Aldrich du composé Acetonitrile, consultée le 10 août 2020.
- « Acétonitrile » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Entrée « Acetonitrile » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10 août 2020 (JavaScript nécessaire)
- « Acetonitrile », sur hazmap.nlm.nih.gov (consulté le )
- Chemistry World Vol. 6 No. 1, janvier 2009, p. 18.
- Portail de la chimie