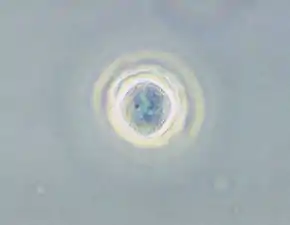
Acanthamoeba
Acanthamoeba est un genre d'amibozoaires, les plus fréquents dans le sol, et aussi fréquemment trouvé dans l'eau douce et d'autres habitats. Les cellules sont petites, typiquement entre 20 et 40 μm de long en fonction des espèces, et peuvent pendre deux formes : une forme dormante, kyste ou une forme active, trophozoïte (aussi nommé végétative). Ces formes leurs permettent de se mouvoir, se diviser et se nourrir plus facilement. Cet organisme peut passer d'une forme à l'autre en fonction des conditions environnementales. Si elles sont favorables à sa croissance, le trophozoïte est observé, alors qu'en cas de stress on observera un kyste. Les pseudopodes forment clairement un lobe hémisphérique antérieur, et il y a différentes courtes extensions filiformes au bord du corps. Elles lui donnent une apparence épineuse à laquelle le nom Acanthamoeba se réfère. Les kystes de la plupart des espèces d'Acanthamoeba sont habituellement de types polygonaux et sont fréquemment retrouvés. La plupart des espèces sont des prédateurs naturels des bactéries libres, mais certaines sont des parasites opportunistes qui peuvent causer des infections aux humains et autres animaux.
Pathogène humain
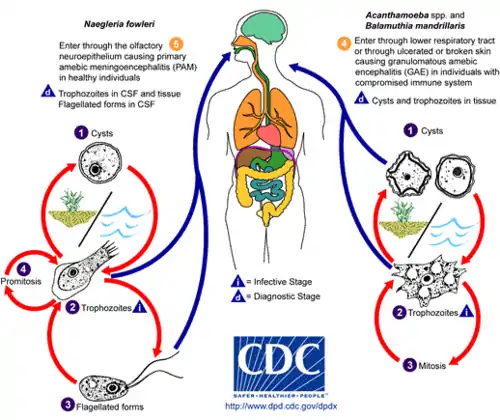
Les maladies causées par Acanthamoeba incluent la kératite amibienne[1] et des encéphalites[2]. Cette dernière est produite lorsque Acanthamoeba pénètre par une blessure ouverte, par inahalation d'aérosols contaminés présent dans l'air ou par la trachée et migre via le système sanguin vers le système nerveux central où elle se développe.
Kératite à Acanthamoeba
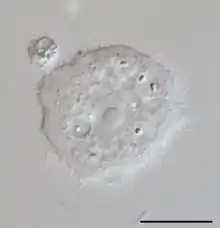
Cette variété de kératite est provoquée par l'invasion de la cornée de l'œil par l'amibe[1]. Elle est rare mais problématique car « le traitement est long, difficile et souvent mis en échec. »[3].
Dans les pays développés, elle est presque toujours associée à l'utilisation de lentilles de contact, car Acanthamoeba peut survivre dans l'espace entre la lentille et l'œil[4],[5],[6],[7]. Pour cette raison, les lentilles de contact doivent être désinfectées avec soin avant le port, et retirées avant des activités nautiques.
Ailleurs dans le monde, les infections surviennent aussi chez des personnes non porteuses de lentilles[8],[9].
Pour détecter Acanthamoeba sur une lentille de contact en laboratoire, on prépare une gélose pour dénombrement avec une couche de E. coli ; une partie de la lentille est mise en contact avec la gélose. Si des Acanthamoeba sont présentes, elles vont ingérer les bactéries en laissant une zone claire autour de la lentille. Une réaction en chaîne par polymérase (PCR) peut aussi être utilisée pour diagnostiquer la kératite à Acanthamoeba, spécialement lorsque des lentilles de contact ne sont pas impliquées.
Signes et symptômes : ils incluent une forte douleur, une kératite sévère, une perineuritis, et un ulcère cornéal en forme d'anneau (encore qu'il arrive tardivement dans le déroulement de la maladie)[10]. ; la prise en charge implique un dialogue étroit entre le clinicien et le biologiste ainsi qu'un « prélèvement de qualité et des tests de laboratoire rapides et performants »[3].
Un traitement utilisé est le polyhexaméthylène[11]. L'iséthionate de propamidine a aussi montré quelques effets[12]. Un autre agent possible est la chlorhexidine[13]. Une greffe cornéenne est parfois requise[12]. Un traitement combiné de propamidine, nitrate de miconazole et néomycine a aussi été proposé[14].
Rappel par Advanced Medical Optics
En , Advanced Medical Optics, fabricant des solutions "Complete Moisture Plus" pour lentilles de contact, a émis un rappel volontaire de leurs solutions "Complete Moisture Plus". La crainte était que les porteurs de lentilles utilisant "Complete Moisture Plus" avaient un risque plus élevé que ceux utilisant d'autres produits de contracter une kératite à Acanthamoeba.
Le fabricant a rappelé le produit après que le Centers for Disease Control des États-Unis a trouvé 21 individus qui auraient été infectés par Acanthamoeba après avoir utilisé Complete Moisture Plus dans le mois précédant le diagnostic[15].
Encéphalite amibienne granulomateuse
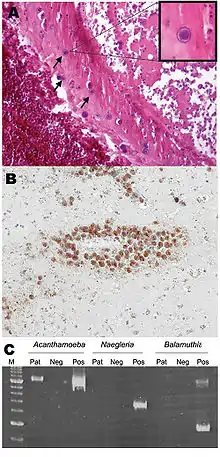
Acanthamoeba est un protozoaire pathogène opportuniste qui cause rarement des maladies humaines. Environ 400 cas ont été recensés dans le monde [Quand ?], mais avec un taux de survie de seulement 2 à 3 %. L'infection se produit habituellement chez des patients souffrant d'immunodeficience, diabète, maladies malignes, malnutrition, lupus érythémateux disséminé, ou alcoolisme. [réf. nécessaire] L'entrée du parasite se fait par des lésions de la peau ou de la trachée, ou par l'inhalation de kystes en suspension dans l'air. Le parasite se propage ensuite par le système sanguin dans le système nerveux central. Acanthamoeba traverse la barrière hémato-encéphalique par des moyens qui ne sont pas encore compris. L'invasion subséquente des tissus conjonctifs et l'induction de réponses inflammatoires conduit à des dommages neuronaux qui peuvent être fatals en quelques jours. Une biopsie post-mortem revèle de graves œdèmes et une nécrose hémorragique[16]. Un patient qui contracte cette maladie montre des symptômes variés : état mental altéré, maux de tête, fièvre, rigidité de la nuque, convulsions, ainsi que des signes neurologiques tels qu'une paralysie du nerf crânien et coma, tous conduisant à la mort en quelques semaines[17]. En raison de la rareté de ce parasite et du manque de connaissances, il n'existe actuellement aucun diagnostic ni traitement efficace d'Acanthamoeba.
L'infection ressemble souvent à celle d'une méningite bactérienne ou tuberculeuse, ou d'une encéphalite virale. Un mauvais diagnostic conduit souvent à un traitement erroné, donc inefficace. Dans le cas où Acanthamoeba est diagnostiqué correctement, les traitements actuels avec amphotéricine-B, rifampicine, cotrimoxazole (triméthoprime-sulfaméthoxazole), ketokonazole, fluconazole, sulfadiazine, albendazole ne sont qu'occasionnellement couronnés de succès. Un diagnostic correct et rapide, de meilleures méthodes de traitement ainsi qu'une meilleure compréhension du parasite sont des facteurs importants pour améliorer les conséquences d'une infection par Acanthamoeba.
MRSA
Le staphylocoque doré résistant à la méticilline (MRSA) est un important pathogène en milieu hospitalier en raison de sa résistance à de nombreux antibiotiques. Des découvertes récentes de l'Université de Bath montrent que MRSA peut infecter et se répliquer dans Acanthamoeba polyphaga, une espèce d'Acanthamoeba largement répandue dans l'environnement. Comme A. polyphaga peut former des kystes, les kystes infectés par MRSA peuvent agir comme agent de dispersion aérienne du MRSA.[réf. nécessaire] De plus, il est mentionné que « des preuves avec d'autres pathogènes suggèrent que les pathogènes émergeant d'amibes sont plus résistants aux anticorps et plus virulents. »[18] Il est observé qu'Acanthamoeba peut augmenter le nombre de MRSA d'un facteur 1000[19].
Importance dans l'écologie des sols
A. castellanii se trouve en grande concentration dans de nombreux écosystèmes de sol. Elle se nourrit de bactéries, mais aussi de champignons et d'autres protozoaires.
Cette espèce est aussi capable de lyser des bactéries et de produire une large gamme d'enzymes comme les cellulases et les chitinases[20] et contribue probablement à la dégradation des matières organiques dans le sol, contribuant à la boucle microbienne.
Espèces
Les espèces d'Acanthamoeba se distinguent surtout d'après leurs kystes. Ces espèces sont divisées en 12 groupes (du T-1 à T-12), basés sur la séquence ADN du ribosome 18S. Elles incluent les suivantes (celles marquées d'un astérisque sont connues comme causant des infections):
- A. astronyxis* (T7)
- A. castellanii* (T4)
- A. comandoni (T9)
- A. culbertsoni* (T10)
- A. divionensis (T4)
- A. griffini (T3)
- A. hatchetti* (T11)
- A. healyi (T12)
- A. jacobsi
- A. keratitis*
- A. lenticulata (T3)
- A. lugdunensis* (T4)
- A. mauritaniensis (T4)
- A. palestinensis* (T1)
- A. pearcei
- A. polyphaga* (T4)
- A. pustulosa (T2)
- A. quina*
- A. rhysodes* (T4)
- A. royreba
- A. terricola (renommé A. castellanii Poussard)
- A. triangularis (T4)
- A. tubiashi (T8)
Endosymbiotes d'Acanthamoeba
Les espèces d'Acanthamoeba contiennent divers endosymbiotes bactériens qui sont similaires à des pathogènes humains. En raison de cela, ils sont considérés comme de potentiels pathogènes humains émergents[21]. La nature exacte de ces symbiotes et les bénéfices qu'ils représentent pour leur amibe hôte doivent encore être clarifiés.
Ils incluent Legionella et des pathogènes similaires[22].
Rôle comme organisme modèle
Comme Acanthamoeba ne diffère pas beaucoup d'une cellule de mammifère au niveau ultrastructural, c'est un modèle attractif pour les études en biologie cellulaire. Acanthamoeba est important en microbiologie cellulaire, biologie environnementale, physiologie, interactions cellulaires, biologie moléculaire, biochimie ainsi que dans l'étude de l'évolution. Ceci est dû à la versatilité de cet organisme dans l'écosystème ainsi qu'à sa capacité de capturer des proies par phagocythose, servir de vecteur ou de réservoir à microbes pathogènes, et produire des infections humaines. De plus, Acanthamoeba a été intensivement utilisé pour comprendre la biologie moléculaire de la mobilité cellulaire[23].
Grâce à la facilité et au bas coût de sa culture, la souche Neff de A. castellanii découverte dans un étang du Golden Gate Park dans les années 1960 a été efficacement utilisée comme un organisme modèle classique dans le domaine de la biologie cellulaire. À partir de 30 litres d'un medium simple inoculé avec A. castellanii, environ 1 kg de cellules peuvent être obtenues après quelques jours de culture aérée à température ambiante. Débutée dans le laboratoire du Dr. Edward D. Korn au National Institutes of Health (NIH), de nombreuses molécules biologiques ont été découvertes et leur fonctionnement élucidé grâce au modèle Acanthamoeba. Le Dr. Thomas Dean Pollard a ensuite appliqué ce modèle au NIH, Harvard Medical School, Johns Hopkins University School of Medicine et au Salk Institute for Biological Studies pour découvrir et caractériser de nombreuses protéines essentielles à la mobilité cellulaire non seulement dans les amibes mais dans beaucoup d'autres cellules eukaryotes, notamment celles des systèmes nerveux et immunitaire humains, de l'embryon en développement, et de cellules cancéreuses.
Références
- C Di Gregorio et Rivasi F, Mongiardo N, De Rienzo B, Wallace S, Visvesvara GS, « Acanthamoeba meningoencephalitis in a patient with acquired immunodeficiency syndrome », Archives of Pathology & Laboratory Medicine, vol. 116, no 12, , p. 1363–5 (PMID 1456885)
- D Lakomy, M Soulié, J Bador, S Valot, C L’Ollivier, F Dalle, A Bron, C Creuzot-Garcher, O Vagner, A Bonnin (2005) Une kératite à amibes libres chez un non porteur de lentilles de contact ; Volume 63, numéro 5, septembre-octobre (résumé)
- JD Auran et Starr MB, Jakobiec FA, « Acanthamoeba keratitis. A review of the literature », Cornea, vol. 6, no 1, , p. 2–26 (PMID 3556011, DOI 10.1097/00003226-198706010-00002)
- JOHN D.T. (1993) Opportunistically pathogenic free-living amebae. In: J.P. Kreier and J.R. Baker (Eds.), Parasitic Protozoa. Vol. 3. Academic Press, New York, p. 143–246.
- PR Badenoch et Adams M, Coster DJ, « Corneal virulence, cytopathic effect on human keratocytes and genetic characterization of Acanthamoeba », International journal for parasitology, vol. 25, no 2, , p. 229–39 (PMID 7622330, DOI 10.1016/0020-7519(94)00075-Y)
- JY Niederkorn et Alizadeh H, Leher H, McCulley JP, « The pathogenesis of Acanthamoeba keratitis », Microbes and Infection, vol. 1, no 6, , p. 437–43 (PMID 10602676, DOI 10.1016/S1286-4579(99)80047-1)
- S Sharma, P Garg et GN Rao, « Patient characteristics, diagnosis, and treatment of non-contact lens related Acanthamoeba keratitis. », The British journal of ophthalmology, vol. 84, no 10, , p. 1103–8 (PMID 11004092, PMCID 1723254, DOI 10.1136/bjo.84.10.1103)
- Bharathi JM, Srinivasan M, Ramakrishnan R, Meenakshi R, Padmavathy S, Lalitha PN, « A study of the spectrum of Acanthamoeba keratitis: a three-year study at a tertiary eye care referral center in South India », Indian J Ophthalmol, vol. 55, no 1, , p. 37–42 (PMID 17189885, DOI 10.4103/0301-4738.29493, lire en ligne)
- Gunisha Pasricha et Savitri Sharma, Prashant Garg, Ramesh K. Aggarwal, « Use of 18S rRNA Gene-Based PCR Assay for Diagnosis of Acanthamoeba Keratitis in Non-Contact Lens Wearers in India », Journal of Clinical Microbiology, vol. 41, no 7, , p. 3206–3211 (PMID 12843065, PMCID 165372, DOI 10.1128/JCM.41.7.3206-3211.2003)
- Sharma S, Garg P, Rao GN, « Patient characteristics, diagnosis, and treatment of non-contact lens related Acanthamoeba keratitis », Br J Ophthalmol, vol. 84, no 10, , p. 1103–8 (PMID 11004092, PMCID 1723254, DOI 10.1136/bjo.84.10.1103, lire en ligne)
- Lindsay RG, Watters G, Johnson R, Ormonde SE, Snibson GR, « Acanthamoeba keratitis and contact lens wear », Clin Exp Optom, vol. 90, no 5, , p. 351–60 (PMID 17697181, DOI 10.1111/j.1444-0938.2007.00172.x)
- Hammersmith KM, « Diagnosis and management of Acanthamoeba keratitis », Curr Opin Ophthalmol, vol. 17, no 4, , p. 327–31 (PMID 16900022, DOI 10.1097/01.icu.0000233949.56229.7d, lire en ligne)
- (en) « Acanthamoeba: Treatment & Medication - eMedicine Infectious Diseases » (consulté en )
- http://www.amo-inc.com/pdf/pr-cmp.pdf
- N Khan, « Acanthamoeba invasion of the central nervous system », International Journal for Parasitology, vol. 37, no 2, , p. 131–8 (PMID 17207487, DOI 10.1016/j.ijpara.2006.11.010)
- V Kaushal et Chhina DK, Kumar R, Pannu HS, Dhooria HPS, Chhina RS, « Acanthamoeba Encephalitis », Indian Journal of Medical Microbiology, vol. 26, no 2, , p. 182–4 (PMID 18445961)
- (en) « MRSA use amoeba to spread, sidestepping hospital protection measures, new research shows », University of Bath, (consulté le )
- (en) « Single Cell Amoeba Increases MRSA Numbers One Thousand Fold », Blackwell Publishing, (consulté le )
- I. J. Anderson et Watkins, R. F., Samuelson, J., Spencer, D. F., Majoros, W. H., Gray, M. W. and Loftus, B. J., « Gene Discovery in the Acanthamoeba castellanii Genome », Protist, vol. 156, no 2, , p. 203–14 (PMID 16171187, DOI 10.1016/j.protis.2005.04.001)
- M Horn et Wagner, M, « Bacterial Endosymbionts of Free-living Amoebae », Journal of Eukaryotic Microbiology, vol. 51, no 5, , p. 509–14 (PMID 15537084, DOI 10.1111/j.1550-7408.2004.tb00278.x)
- (en) FL. Schuster et GS. Visvesvara, « Opportunistic amoebae: challenges in prophylaxis and treatment », Drug resistance updates: reviews and commentaries in antimicrobial and anticancer chemotherapy, vol. 7, no 1, , p. 41–51 (PMID 15072770, DOI 10.1016/j.drup.2004.01.002)
- (en) Khan N, Acanthamoeba: Biology and Pathogenesis, Caister Academic Press, (ISBN 978-1-904455-43-1, lire en ligne)
Voir aussi
Articles connexes
Liens externes
- Acanthamoeba - Centers for Disease Control and Prevention
- Video of Acanthamoeba from contact lens keratitis
- Animal Planet - Monsters Inside Me: The Eye-Eating Parasite (vidéo)
- Acanthamoeba spp. as Agents of Disease in Humans - Clinical Microbiology Reviews, accessed on 4 February 2006
- Comprehensive resource on Amoeba
- Eye health and Acanthamoeba
- Acanthamoeba pictures and illustrations
- Advanced Medical Optics recall of Moisture Plus products
- Acanthamoeba, voire pire article de blog
- http://nuxeo.edel.univ-poitiers.fr/nuxeo/site/esupversions/65a8b77a-f0c6-4307-a97f-cdcb4d5132a1
- https://tel.archives-ouvertes.fr/tel-01858353/document
- Portail de la microbiologie
- Portail des maladies infectieuses