Accumulateur aluminium-ion
Les accumulateurs aluminium-ion sont un type d’accumulateurs rechargeables dans lesquels des ions aluminium fournissent de l’énergie électrique en s’écoulant de l’anode négative de l’accumulateur à son électrode positive, la cathode. Pendant la recharge, les ions aluminium retournent à l’anode.
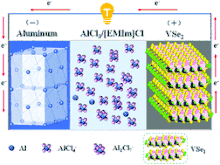
Principe
Comme tous les accumulateurs, la structure d’un accumulateur aluminium-ion comprend deux électrodes connectées par un électrolyte, un matériau conducteur pour les porteurs de charge, ici les ions aluminium. La puissance d’un accumulateur dépend de facteurs tels que : son voltage intrinsèque, sa capacité et sa composition chimique. On peut optimiser la capacité énergétique d’un accumulateur :
Recherches en cours
De nombreuses équipes de recherche expérimentent l’aluminium pour tenter de produire des accumulateurs plus efficaces et de plus longue durée de vie.
Université Stanford
Les chercheurs de l'université Stanford, en Californie, ont annoncé le développement d’un accumulateur aluminium-ion (Al-ion) ayant un temps de recharge d’environ une minute, sans préciser toutefois la capacité de l’accumulateur. Ils déclarent leur accumulateur ininflammable, montrant une vidéo dans laquelle un accumulateur est percé durant son fonctionnement[2]. Cet accumulateur devrait être bon marché[3]. La tension fournie par l'accumulateur est de deux volts environ.
Le prototype a été testé durant 7 500 cycles de charge-décharge sans perte de capacité[4],[5].
Laboratoire national d'Oak Ridge
Le Laboratoire national d'Oak Ridge (ORNL), dans le Tennessee, a développé un accumulateur à haute densité d'énergie produisant 1 060 Wh/kg contre 406 Wh/kg pour l’accumulateur lithium-ion[6].
L'ORNL a utilisé pour cela un électrolyte ionique au lieu d’un électrolyte en phase aqueuse qui peut en fonctionnement produire de l’hydrogène qui érode l’anode d’aluminium. Cet électrolyte est constitué de chlorure de 3-éthyl-1-méthylimidazolium avec un excès de trichlorure d'aluminium[7]. Cependant, les électrolytes ioniques sont moins bons conducteurs, ce qui réduit la densité de puissance. En réduisant la distance entre anode et cathode, on peut compenser la perte de conductivité au prix d’un échauffement de l'accumulateur. L'ORNL a aussi développé une cathode d’oxyde de manganèse de structure spinelle pour réduire la corrosion[8].
Université Cornell
À l’université Cornell, une équipe a utilisé le même électrolyte que le Laboratoire d’Oak Ridge mais elle a utilisé des nanofils d’oxyde de vanadium à la cathode[9]. L’oxyde de vanadium présente une structure ouverte à grande surface spécifique qui augmente la surface active d’aluminium et réduit la distance anode-cathode, augmentant ainsi l’énergie disponible. Le dispositif a produit une tension de sortie élevée mais une faible efficacité de Faraday (forte auto-décharge)[7].
Électrochimie
Demi-réaction à l'anode :
Demi-réaction à la cathode :
La combinaison des deux demi-réactions donne :
Comparaison avec Li-ion
L’accumulateur aluminium-ion est similaire à l’accumulateur lithium-ion où on a remplacé le lithium par l’aluminium à l’anode. La tension théorique des accumulateurs à l’aluminium est plus faible que celle du lithium, 2,65 V au lieu de 4 V, mais la densité d’énergie pour les accumulateurs à l’aluminium est de 1 060 Wh/kg tandis qu’elle n’est que de 406 Wh/kg pour le lithium[8]. Cette importante différence de capacité énergétique est due à la trivalence des ions aluminium, les ions lithium sont monovalents. Par ailleurs, l’aluminium est plus abondant que le lithium, ce qui devrait conduire à une baisse de prix des accumulateurs[6].
Défis
Les accumulateurs Al-ion ont une relativement courte durée de conservation. La combinaison de paramètres tels qu'échauffement, vitesse de charge et nombre de cycles peut très fortement diminuer la capacité énergétique de ces accumulateurs. Un accumulateur à ions métalliques complètement déchargé ne peut pas être rechargé. Les électrolytes ioniques sont chers. Comme tous les types d’accumulateur, leur capacité énergétique est bien plus faible que l'énergie chimique de l’essence, par exemple[10].
Références
- M. Armand et J.-M Tarascon, « Building better batteries », sur nature.com, Nature (consulté le )
- Meng-Chang Lin, Ming Gong, Bingan Lu, Yingpeng Wu, Di-Yan Wang, Mingyun Guan, Michael Angell, Changxin Chen, Jiang Yang, Bing-Joe Hwang et Hongjie Dai, « An ultrafast rechargeable aluminium-ion battery », Nature, (DOI 10.1038/nature14340)
- « Ultra-fast charging aluminum battery offers safe alternative to conventional batteries », sur Phys.org (consulté le )
- « Stanford Researchers Unveil New Ultrafast Charging Aluminum-Ion Battery », scientificamerican.com
- Meng-Chang Lin et al., An ultrafast rechargeable aluminium-ion battery, Nature, 16 avril 2015
- M. Parans Paranthaman et Gilbert Brown, « Aluminium ION Battery », sur web.ornl.gov, Oak Ridge National Laboratory (consulté le )
- Leland Teschler, « Goodbye to lithium-ion batteries? », sur machinedesign.com, machine design, (consulté le )
- (en) « Aluminum-Ion Battery to Transform 21st Century Energy Storage » [PDF], sur web.ornl.gov, Oak Ridge National Laboratory (consulté le )
- N. Jayaprakash, S. K. Das et L. A. Archer, « The rechargeable aluminum-ion battery », sur pubs.rsc.org, rsc, (consulté le )
- John Hewitt, « DoE calls for a chemical battery with 5x capacity, within 5 years – can it be done? », sur extremetech.com/, Extreme Tech (consulté le )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Aluminium-ion battery » (voir la liste des auteurs).
Articles connexes
- Portail de l’énergie
- Portail de l’électricité et de l’électronique
- Portail de la chimie