Accumulateur lithium-soufre
Un accumulateur lithium-soufre, batterie lithium-soufre ou batterie Li-S, est un type d'accumulateur lithium. Son intérêt principal est sa densité énergétique importante en raison de la faible masse atomique du lithium, de la masse modérée de l'octa-soufre et de sa capacité à échanger jusqu'à 16 électrons. Le soufre est de plus un matériau bon marché et abondant naturellement contrairement au cobalt, utilisé dans les batteries lithium-ion dites "classiques". L'un des principaux inconvénient est l'effet "navette", limitant le rendement énergétique et dégradant l'accumulateur. Les batteries utilisant cette technologie ne sont à ce jour pas disponibles commercialement, mais font l'objet de plusieurs projets de recherche.
| Accumulateur lithium-soufre | |
| |
| Caractéristiques | |
|---|---|
| Énergie/Poids | jusqu' à 500[1] Wh/kg |
Caractéristiques
La densité énergétique d'un accumulateur lithium-soufre va jusqu'à 2 600 Wh/kg contre 300 pour un accumulateur lithium-ion[2]. De plus les accumulateurs lithium-soufre permettent de meilleures performances à basse température et dépendent de composants moins chers et moins toxiques[3]. À l'heure actuelle, plusieurs équipes de recherche sont parvenues à obtenir des batteries ne subissant pas de pertes importantes de capacité après plusieurs centaines de cycles[4],[5],[6] voir dans certains cas 1000 cycles[7], le seuil à partir duquel les batteries commencent à être exploitables commercialement. Les principaux enjeux restants à résoudre sont la suppression de l'effet navette et la re-déposition correcte du soufre lors de la charge[8].
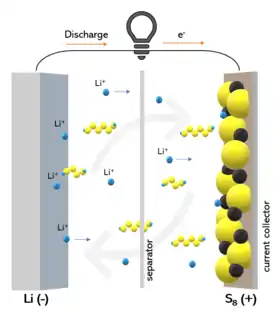
Principe de fonctionnement
L'anode est composée de lithium et la cathode de soufre[2]. Lors de la décharge de la batterie, le lithium se dissout sur la surface de l'anode, et se dépose sur l'anode lors de la charge[9].
La réaction chimique de décharge est :
- S8 → Li2S8 → Li2S6 → Li2S4 → Li2S3
Et celle de charge :
- Li2S → Li2S2 → Li2S3 → Li2S4 → Li2S6 → Li2S8 → S8
Problématiques
Effet navette
L'effet navette est un phénomène limitant les performances énergétiques des accumulateurs Li-S. Le problème réside dans la solubilité très importantes des complexes lithium-polysulfures [10]. Ces espèces, après leur formation à la cathode, diffusent de façon importante vers l'anode et s'y réduisent en consommant des charges. À leur tour, les ions polysulfures à courtes chaines diffusent vers la cathode où ils s'oxyderont. Ces cycles répétés prennent la forme d'aller-retours ou de "navette". Chaque réduction et oxydation consomme des charges qui auraient normalement participé à la recharge de la batterie.
Déposition du soufre
Le fonctionnement de la batterie repose sur les contacts électriques entre électrode et espèce active. La problématique dans ce cas là se situe à la cathode, le plus souvent constituée de noir de carbone sur lequel est déposé du soufre à l'état solide, peu conducteur[11]. Lors de la décharge, le soufre est dissous en de nombreuses sous-espèces, cédant à chaque étape des électrons qui constituent le réel stockage électrique. Si lors de la fabrication des électrodes il est aisé d'avoir un excellent contact entre le carbone et le soufre, cela n'est pas vrai pour les cycles suivants pendant lesquels le soufre se redéposera de façon hétérogène sur la cathode, détériorant ainsi les performances. Les stratégies actuelles reposent sur une nano-texturation de l'interface soufre-carbone afin de faciliter les contacts électriques.[12],[13],[14]
Historique
En 1843, Wackenroder expérimente sur le soufre[15]. Ses découvertes seront réutilisées par des chercheurs en 2015[2]. En 2013, des chercheurs de l'université de Stanford ont su produire un accumulateur lithium-soufre qui garde 80 % de ses capacités après 300 cycles de recharge[16].
En 2017, un institut du CEA réussit à réaliser un prototype de pile lithium-soufre cylindrique performant et constate une importante marge de progression[17]. La même année, des chercheurs de l'institut Paul Scherrer et de l'université Grenoble-Alpes découvrent que l'ajout de quartz apporte de meilleures performances[18].
Le 3 janvier 2020, des chercheurs annoncent avoir mis au point un processus de fabrication pouvant être industrialisé facilement[19].
Utilisation
Les accumulateurs lithium-soufre pourraient être utilisés dans les automobiles électriques, leur apportant une autonomie de 1 000 km, ou dans les smartphones, pour une autonomie de cinq jours[20].
Notes et références
- (en) Loz Blain, « Ultra-dense lithium-sulfur battery doubles range of electric planes », sur newatlas.com, (consulté le ).
- Nathalie Meyer, « Des batteries lithium-soufre, une solution pour la voiture électrique ? », sur futura sciences, (consulté le ).
- Emmanuel Genty, « Des batteries lithium-soufre bientôt à la place des batteries lithium-ion ? », sur CNET, (consulté le ).
- Lei Wang, Dong Wang, Fengxing Zhang et Jian Jin, « Interface Chemistry Guided Long-Cycle-Life Li–S Battery », Nano Letters, vol. 13, no 9, , p. 4206–4211 (ISSN 1530-6984, DOI 10.1021/nl4018868, lire en ligne, consulté le )
- (en) Guoqiang Ma, Zhaoyin Wen, Jun Jin et Meifen Wu, « Enhanced cycle performance of Li–S battery with a polypyrrole functional interlayer », Journal of Power Sources, vol. 267, , p. 542–546 (ISSN 0378-7753, DOI 10.1016/j.jpowsour.2014.05.057, lire en ligne, consulté le )
- (en) Ruichao Lu, Meng Cheng, Lijuan Mao et Miao Zhang, « Nitrogen‐doped nanoarray‐modified 3D hierarchical graphene as a cofunction host for high‐performance flexible Li‐S battery », EcoMat, vol. 2, no 1, (ISSN 2567-3173 et 2567-3173, DOI 10.1002/eom2.12010, lire en ligne, consulté le )
- (en) Xin-Bing Cheng, Jia-Qi Huang, Hong-Jie Peng et Jing-Qi Nie, « Polysulfide shuttle control: Towards a lithium-sulfur battery with superior capacity performance up to 1000 cycles by matching the sulfur/electrolyte loading », Journal of Power Sources, vol. 253, , p. 263–268 (ISSN 0378-7753, DOI 10.1016/j.jpowsour.2013.12.031, lire en ligne, consulté le )
- (en) Hui Pan, Zhu Cheng, Ping He et Haoshen Zhou, « A Review of Solid-State Lithium–Sulfur Battery: Ion Transport and Polysulfide Chemistry », Energy & Fuels, vol. 34, no 10, , p. 11942–11961 (ISSN 0887-0624 et 1520-5029, DOI 10.1021/acs.energyfuels.0c02647, lire en ligne, consulté le )
- (en) Tudron, F.B., Akridge, J.R., and Puglisi, V.J. (2004) « Lithium-Sulfur Rechargeable Batteries: Characteristics, State of Development, and Applicability to Powering Portable Electronics » (Tucson, AZ: Sion Power).
- (en) Yan Diao, Kai Xie, Shizhao Xiong et Xiaobin Hong, « Shuttle phenomenon – The irreversible oxidation mechanism of sulfur active material in Li–S battery », Journal of Power Sources, vol. 235, , p. 181–186 (ISSN 0378-7753, DOI 10.1016/j.jpowsour.2013.01.132, lire en ligne, consulté le )
- (en) Ali Eftekhari et Dong-Won Kim, « Cathode materials for lithium–sulfur batteries: a practical perspective », Journal of Materials Chemistry A, vol. 5, no 34, , p. 17734–17776 (ISSN 2050-7496, DOI 10.1039/C7TA00799J, lire en ligne, consulté le )
- Ding-Rong Deng, Fei Xue, Yue-Ju Jia et Jian-Chuan Ye, « Co4N Nanosheet Assembled Mesoporous Sphere as a Matrix for Ultrahigh Sulfur Content Lithium–Sulfur Batteries », ACS Nano, vol. 11, no 6, , p. 6031–6039 (ISSN 1936-0851, DOI 10.1021/acsnano.7b01945, lire en ligne, consulté le )
- (en) Xin-Xing Peng, Yan-Qiu Lu, Li-Li Zhou et Tian Sheng, « Graphitized porous carbon materials with high sulfur loading for lithium-sulfur batteries », Nano Energy, vol. 32, , p. 503–510 (ISSN 2211-2855, DOI 10.1016/j.nanoen.2016.12.060, lire en ligne, consulté le )
- (en) Xiulei Ji, Kyu Tae Lee et Linda F. Nazar, « A highly ordered nanostructured carbon–sulphur cathode for lithium–sulphur batteries », Nature Materials, vol. 8, no 6, , p. 500–506 (ISSN 1476-4660, DOI 10.1038/nmat2460, lire en ligne, consulté le )
- Fortin, Masson et Cie, Rapport annuel sur les progrès de la chimie, (lire en ligne).
- David Civera, « Augmenter la durée de vie des batteries au lithium-soufre », sur Tom's hardware, .
- « La batterie lithium-soufre passe à l’échelle supérieure », sur CEA, (consulté le ).
- « PSI : la batterie lithium-soufre en progrès grâce au quartz », sur RFJ, (consulté le )
- (en) Mahdokht Shaibani, Meysam Sharifzadeh Mirshekarloo, Ruhani Singh et Christopher D. Easton, « Expansion-tolerant architectures for stable cycling of ultrahigh-loading sulfur cathodes in lithium-sulfur batteries », Science Advances, vol. 6, no 1, , eaay2757 (ISSN 2375-2548, DOI 10.1126/sciadv.aay2757, lire en ligne, consulté le )
- « Du soufre dans nos batteries (rediffusion) », sur rfi.fr, (consulté le ).
Articles connexes
Lien externe
- Portail de l’énergie
- Portail de l’électricité et de l’électronique
- Portail de la chimie