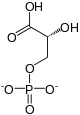
Acide 2,3-bisphosphoglycérique
L’acide 2,3-bisphosphoglycérique — ou 2,3-bisphosphoglycérate sous forme déprotonée, abrégée en 2,3-BPG — est un composé organique, isomère de l'acide 1,3-bisphosphoglycérique, un important intermédiaire métabolique de la glycolyse. Il intervient, chez l'espèce humaine, dans la régulation du transport de l'oxygène dans le sang, en stabilisant la forme désoxy de l'hémoglobine. Cette stabilisation diminue l'affinité de l'hémoglobine pour l'oxygène, permettant sa libération à proximité des tissus cibles.
Pour les articles homonymes, voir BPG.
| Acide 2,3-bisphosphoglycérique | |
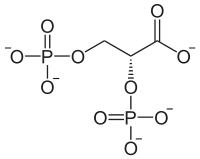 Structure du 2,3-bisphospho-D-glycérate. |
|
| Identification | |
|---|---|
| Nom UICPA | Acide 2,3-diphosphonooxypropanoïque |
| Synonymes |
2,3-BPG |
| No CAS | |
| PubChem | 61 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C3H8O10P2 [Isomères] |
| Masse molaire[1] | 266,037 1 ± 0,006 g/mol C 13,54 %, H 3,03 %, O 60,14 %, P 23,29 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Il se forme à partir du 1,3-bisphospho-D-glycérate (1,3-BPG) sous l'action de la bisphosphoglycérate mutase, une enzyme spécifique aux érythrocytes et aux cellules du placenta :
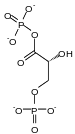

1,3-BPG 2,3-bisphospho-D-glycérate Bisphosphoglycérate mutase – EC
Il est ensuite converti en 3-phospho-D-glycérate (3PG) par la bisphosphoglycérate phosphatase :
Il s'agit d'une voie détournée de la glycolyse, court-circuitant l'étape catalysée par la 3-phosphoglycérate kinase. Le 2,3-BPG agit en augmentant la stabilité de la forme désoxy de l'hémoglobine, induisant par conséquent le passage de la forme oxy à la forme désoxy avec libération d'oxygène[2].
Il possède effectivement une action hétérotrope négative, c'est-à-dire que le 2,3-BPG inhibe la fixation de l'oxygène. Le 2,3-BPG constitue un effecteur allostérique de l'hémoglobine.
C'est donc un régulateur du transport d'oxygène dans le sang, qui rend ce dernier globalement plus efficace et intervient en particulier dans l'adaptation aux altitudes élevées, caractérisées par une pression atmosphérique inférieure, impliquant une fraction inspirée en oxygène inférieur à celle du niveau de la mer. Un taux élevé est également retrouvé en cas d'insuffisance cardiaque[3].
L'augmentation du taux de 2,3-BPG est secondaire à l'activation de l'AMPK érythrocytaire, cette dernière induisant une phosphorylation de la bisphosphoglycérate mutase entraînant une production accrue de 2,3-BPG[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- G.J. Brewer, « 2,3-BPG and erythrocyte oxygen affinity », Annu Rev Med, vol. 25, , p. 29–38 (résumé)
- Bersin RM, Kwasman M, Lau D, Klinski C, Tanaka K, Khorrami P, DeMarco T, Wolfe C, Chatterjee K, « Importance of oxygen-haemoglobin binding to oxygen transport in congestive heart failure », Br Heart J, vol. 70, , p. 443–447 (DOI 10.1136/hrt.70.5.443, lire en ligne)
- Liu H, Zhang Y, Wu H et al., « Beneficial role of erythrocyte adenosine A2B receptor–mediated AMP-activated protein kinase activation in high-altitude Hhypoxia », Circulation, vol. 134, , p. 405-421 (lire en ligne)
Voir aussi
Liens externes
- (en) General Practice Notebook « 2,3-DPG. »
- Portail de la biochimie
- Portail de la chimie
- Portail de l’hématologie