Acide peroxydisulfurique
L’acide peroxydisulfurique, parfois appelé acide peroxodisulfurique ou acide de Marshall, est un oxoacide de soufre de formule brute H2S2O8. Il se présente sous forme d'un solide blanc à cristaux incolores solubles dans l'eau. C'est un oxydant fort, dont les sels — contenant l'ion peroxydisulfate et couramment appelés persulfates — sont plus stables et ont une bien plus grande importance dans l'industrie, où ils sont utilisés comme oxydants, comme le persulfate d'ammonium (NH4)2S2O8.
| Acide peroxydisulfurique | |
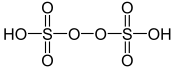 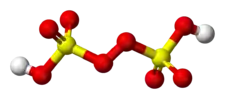 Molécule d'acide peroxydisulfurique |
|
| Identification | |
|---|---|
| Synonymes |
acide peroxodisulfurique |
| No CAS | |
| PubChem | 24413 |
| ChEBI | 29268 |
| SMILES | |
| InChI | |
| Apparence | solide blanc à cristaux incolores |
| Propriétés chimiques | |
| Formule | H2S2O8 |
| Masse molaire[1] | 194,141 ± 0,013 g/mol H 1,04 %, O 65,93 %, S 33,03 %, |
| Propriétés physiques | |
| T° fusion | 65 °C (décomposition) [2] |
| Unités du SI et CNTP, sauf indication contraire. | |
L'acide peroxydisulfurique trouve des applications dans la production du peroxyde d'hydrogène H2O2 par hydrolyse, l'hydroxylation de phénols et, en solution, le décapage des métaux dans certains traitements de surface. On peut le produire par électrolyse sous forte densité de courant d'une solution d'acide sulfurique H2SO4 à 50 %, ou à partir d'acide peroxymonosulfurique H2SO5 avec un excès d'acide chlorosulfonique HSO3Cl.
Sa structure peut être décrite par la formule semi-développée HSO3–O–O–SO3H. Le soufre y est à l'état d'oxydation +6, mais il peut avoir en apparence un nombre d'oxydation plus élevé que celui des sulfates SO42− du fait des anions peroxyde O22−.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) J. D'Ans, « Über Derivate des Hydroperoxyds », Zeitschrift für anorganische Chemie, vol. 33, no 1, , p. 1575-359 (DOI 10.1002/zaac.19120730120)