Oxoacide de soufre
Les oxoacides de soufre sont des composés chimiques qui contiennent du soufre, de l'oxygène et de l'hydrogène. Ce sont des acides inorganiques. Le plus connu par son importance industrielle est l'acide sulfurique. Le soufre entre dans la composition de nombreux oxoacides, toutefois certains ne sont connus qu'à travers de sels (écrits en italique dans le tableau ci-dessous). Ces acides comportent différentes formes structurelles, par exemple :
- tétraédrique, lorsque le soufre est au centre d'un tétraèdre dont les sommets sont occupés par quatre atomes d'oxygène
- terminale lié à des atomes d'oxygène
- terminale en groupe peroxo
- terminale S=S
- en chaînes d'atome de soufre : (-S-)n
| Acide | Formule | N.O. du soufre | Structure | Anions | Notes |
|---|---|---|---|---|---|
| Acide sulfurique | H2SO4 | VI | 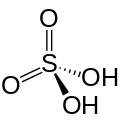 |
Sulfate SO42− et hydrogénosulfate (plus connu sous le nom de bisulfate) HSO4− | Connu pour son utilité industrielle |
| Acide polysulfurique Acide disulfurique |
H2SO4.nSO3 | VI | 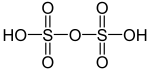 |
Disulfate (également connu comme pyrosulfate) S2O72− et trisulfate S3O102− | La température de fusion de l'acide disulfurique pur est 36 °C. Présent dans l'acide sulfurique fumant, ou oléum. Exemples connu pour n = 1 et 2. |
| Acide peroxymonosulfurique Acide peroxysulfurique |
H2SO5 | VI | 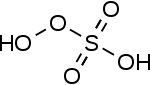 |
Peroxymonosulfate OOSO32− | Acide de Caro, point de fusion : 45 °C |
| Acide peroxydisulfurique | H2S2O8 | VI | 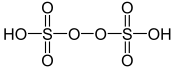 |
Peroxydisulfate O3SOOSO32− | Acide de Marshall, point de fusion : 65 °C. |
| Acide dithionique Acide hypodisulfurique |
H2S2O6 | V |  |
Dithionate O3SSO32− | Ne peut être obtenu pur, mais uniquement en solution concentrée. |
| Acide thiosulfurique | H2S2O3 | II |  |
Thiosulfate S2O32− Hydrogénothiosulfate HS2O3− (le sel d'ammonium est préparé dans le méthanol anhydride à −80 °C[1]) |
Se décompose lorsqu'il est en solution aqueuse. |
| Acide disulfureux ou acide pyrosulfureux | H2S2O5 | IV |  |
Disulfite, plus connu comme métabisulfite, S2O52− | - |
| Acide sulfureux | H2SO3 | IV | 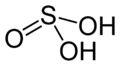 |
Bisulfite HSO3− et sulfite SO32− | - |
| Acide sulfoxylique Acide hyposulfureux |
H2SO2 | II | Acide sulfoxylique |
Hyposulfite SO22− | Hypothétique. |
| Acide dithioneux | H2S2O4 | III | 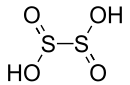 |
Dithionite O2SSO22− | - |
| Acide polythioniques | H2Sx+2O6 | 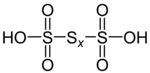 |
Polythionates O3S(Sx)SO32− | Exemples connus avec x = 1, 2, 3, 4, 5, 6, 8, 10 et 12. L'ion tétrathionate correspond ainsi à x = 2. |
Notes et références
- Raman spectroscopic discovery of the hydrogenthiosulphate anion, HSSO3−, in solid NH4HS2O3 Steudel Rr.; Prenzel A Zeitschrift für Naturforschung 1989,44, 12, 1499-1502
- Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2e ed.), Oxford: Butterworth-Heinemann, (ISBN 0080379419)
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.