Acide thiosulfurique
L’acide thiosulfurique est un composé chimique de formule H2S2O3. C'est un oxoacide sulfuré faible, analogue de l'acide sulfurique où un atome d'oxygène est remplacé par un atome de soufre, comme indiqué par le préfixe thio-. Il ne peut pas être obtenu en acidifiant des thiosulfates car il se décompose violemment au contact de l'eau.
| Acide thiosulfurique | |
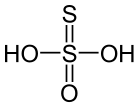 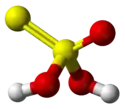 Structure de l'acide thiosulfurique. |
|
| Identification | |
|---|---|
| No CAS | |
| PubChem | 24478 |
| ChEBI | 5587 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H2O3S2 |
| Masse molaire[1] | 114,144 ± 0,011 g/mol H 1,77 %, O 42,05 %, S 56,19 %, |
| pKa | 0,6 et 1,74 |
| Propriétés physiques | |
| T° fusion | décomposition sous 0 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
Les produits de décomposition comprennent, selon les conditions opératoires, le soufre S8, le dioxyde de soufre SO2, le sulfure d'hydrogène H2S, l'acide sulfurique H2SO4, les polysulfanes H2Sn avec n ≥ 1 et les polythionates O3S(Sn)SO32− avec n ≥ 1[2].
Les méthodes de synthèse de l'acide thiosulfurique par voie anhydre ont été développées en 1957 par le chimiste allemand Max Schmidt[3] :
- H2S + SO3 → H2S2O3·nEt2O (dans l'éther diéthylique à −78 °C)
- Na2S2O3 + 2 HCl → 2 NaCl + H2S2O3·2Et2O (dans l'éther diéthylique à −78 °C)
- HSO3Cl + H2S → HCl + H2S2O3 (à basse température).
Mais l'acide anhydre se décompose également en dessous de 0 °C :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Norman N. Greenwood, A. Earnshaw, « Chemistry of the Elements, » Pergamon, Oxford, 1984, pp. 846–48, (ISBN 978-0-08-022057-4).
-
(en) Max Schmidt, « Über Säuren des Schwefels. I. Zur Kenntnis der wasserfreien Thioschwefelsäure », Zeitschrift für anorganische und allgemeine Chemie, vol. 289, nos 1-4, , p. 141-157 (DOI 10.1002/zaac.19572890113)
- Portail de la chimie