Dioxyde de germanium
Le dioxyde de germanium, ou oxyde de germanium(IV), est un composé inorganique de formule chimique GeO2. C'est la principale source commerciale de germanium. On l'obtient en chauffant du germanium ou du disulfure de germanium GeS2 en présence d'oxygène O2 :
| Dioxyde de germanium | |
| |
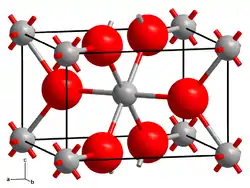
| Structure du dioxyde de germanium tétragonal (rutile) __ Ge4+ __ O2− |
|
| Identification | |
|---|---|
| Nom UICPA | dioxogermane |
| Synonymes |
Oxyde de germanium(IV) |
| No CAS | |
| No ECHA | 100.013.801 |
| No CE | 215-180-8 |
| No RTECS | LY5240000 |
| PubChem | 14796 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche inodore[1] |
| Propriétés chimiques | |
| Formule | GeO2 |
| Masse molaire[2] | 104,64 ± 0,01 g/mol Ge 69,39 %, O 30,58 %, |
| Propriétés physiques | |
| T° fusion | 1 115 °C[1] (hexagonal) 1 086 °C[1] (tétragonal) |
| Solubilité | 4,5 g·L-1[1] |
| Masse volumique | 4,23 g·cm-3[1] (25 °C, hexagonal) 6,239 g·cm-3[1] (25 °C, tétragonal) 3,637 g·cm-3[1] (25 °C, amorphe) |
| Précautions | |
| SGH[1] | |
 Attention |
|
| Écotoxicologie | |
| DL50 | 1 250 mg·kg-1[1] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
Il se forme également par hydrolyse du tétrachlorure de germanium GeCl4 :
Cette réaction diffère de celle observée avec le silicium dans la mesure où l'hydrolyse du tétrachlorure de silicium SiCl4 donne en premier lieu des acides siliciques, tandis que le tétrachlorure de germanium ne forme pas d'hydroxydes stables, mais donne au contraire le dioxyde.
Structure
Les deux principaux polymorphes du dioxyde de germanium sont le GeO2 hexagonal et le GeO2 tétragonal. Le premier est semblable au quartz-β, dans lequel le germanium présente une coordinence de 4, tandis que le second, qui correspond à l'argutite, présente une structure de type rutile, dans lequel le germanium présente une coordinence de 6. Il existe également une forme amorphe semblable à celle du verre de quartz.
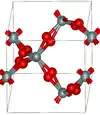 GeO2 hexagonal
GeO2 hexagonal GeO2 tétragonal
GeO2 tétragonal
Le dioxyde de germanium peut être obtenu sous forme cristallisée aussi bien que sous forme amorphe. À pression atmosphérique, la structure amorphe est constituée d'un réseau de tétraèdres GeO4. Lorsque la pression augmente jusqu'à environ 9 GPa, la coordinence moyenne du germanium passe progressivement de 4 à 5, avec un allongement de la liaison Ge–O[3]. Lorsque la pression augmente encore, jusqu'à environ 15 GPa, la coordinence du germanium passe à 6, et il se forme une structure plus dense constituée d'octaèdres GeO6[4]. Si la pression est alors réduite, le cristal reprend sa structure tétraédrique[3],[4]. Si au contraire la pression est augmentée, la forme rutile se transforme en forme orthorhombique de type CaCl2[5].
Applications
L'indice de réfraction du dioxyde germanium de 1,7 ainsi que ses propriétés de dispersion optique en font un matériau intéressant pour les applications optiques telles que les objectifs grand angle, les lentilles pour objectifs de microscopes optiques, et pour le cœur des fibres optiques. Le germanium et son dioxyde sont tous deux transparents dans l'infrarouge. Le verre peut servir à produire des fenêtres et des lentilles pour les rayonnements infrarouges utilisées par exemple dans les jumelles de vision nocturne et les caméras thermiques. La résistance du GeO2 en fait le matériau de prédilection pour les applications militaires.
On utilise un mélange de dioxyde de silicium SiO2 et de dioxyde de germanium GeO2 pour réaliser des fibres optiques et des guides d'ondes optiques (en). Le contrôle précis du rapport entre le silicium et le germanium permet de contrôler précisément l'indice de réfraction du matériau. Ces verres ont une viscosité inférieure et un indice de réfraction supérieur à ceux du dioxyde de silicium pur. Le dioxyde de germanium a remplacé le dioxyde de titane TiO2 comme dopant des fibres en SiO2, ce qui a permis de s'affranchir de la nécessité d'un traitement thermique qui rendait les fibres fragiles.
Le dioxyde de germanium est également utilisé comme catalyseur pour la production de résines de PET[6] ainsi que d'autres composés du germanium, des matériaux luminescents et des matériaux semiconducteurs.
Toxicité
Le dioxyde de germanium présente une faible toxicité mais est néphrotoxique à haute dose.
Il peut être utilisé comme source de germanium dans certains compléments alimentaires discutables[7] dont des doses élevées peuvent provoquer des empoisonnements graves au germanium.
Notes et références
- Entrée « Germanium(IV) oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19 mars 2018 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) James W. E. Drewitt, Philip S. Salmon, Adrian C. Barnes, Stefan Klotz, Henry E. Fischer et Wilson A. Crichton, « Structure of GeO2 glass at pressures up to 8.6 GPa », Physicial Review B, vol. 81, no 1, , article no 014202 (DOI 10.1103/PhysRevB.81.014202, Bibcode 2010PhRvB..81a4202D, lire en ligne)
- (en) M. Guthrie, C. A. Tulk, C. J. Benmore, J. Xu, J. L. Yarger, D. D. Klug, J. S. Tse, H-k. Mao et R. J. Hemley, « Formation and Structure of a Dense Octahedral Glass », Physical Review Letters, vol. 93, no 11, , article no 115502 (PMID 15447351, DOI 10.1103/PhysRevLett.93.115502, Bibcode 2004PhRvL..93k5502G, lire en ligne)
- (en) J. Haines, J. M. Léger, C. Chateau et A. S. Pereira, « Structural evolution of rutile-type and CaCl2-type germanium dioxide at high pressure », Physics and Chemistry of Minerals, vol. 27, no 8, , p. 575-582 (DOI 10.1007/s002690000092, lire en ligne)
- (en) Ulrich K. Thiele, « The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation », International Journal of Polymeric Materials and Polymeric Biomaterials, vol. 50, nos 3-4, , p. 387-394 (DOI 10.1080/00914030108035115, lire en ligne)
- (en) Shyy-Hwa Tao et P. Michael Bolger, « Hazard assessment of germanium supplements », Regulatory Toxicology and Pharmacology, vol. 25, no 3, , p. 211-219 (PMID 9237323, DOI 10.1006/rtph.1997.1098, lire en ligne)
- Portail de la chimie