Processus adiabatique
En thermodynamique, un processus adiabatique est une transformation effectuée sans qu'aucun transfert thermique n'intervienne entre le système étudié et son environnement, c'est-à-dire sans échange de chaleur entre les deux milieux.

Définition
Étymologie
Le mot « adiabatique » a été construit à partir du grec ἀδιάϐατος / adiabatos (« infranchissable »), dérivé de διαϐαίνω / diabaínō, « traverser, franchir »[1],[2].
Un matériau adiabatique est imperméable à la chaleur[2],[3]. Une « enceinte adiabatique » empêche tout échange de chaleur entre un système et son environnement[4]. Dans ce sens, les mots « atherme » et « athermane » sont synonymes[5].
Une transformation thermodynamique dans laquelle le système étudié n'échange aucune chaleur avec son environnement est dite « transformation adiabatique » ou « processus adiabatique »[2],[3]. Dans ce sens, le mot « athermique » est synonyme[6].
Une « courbe adiabatique », ou plus simplement une « adiabatique », est une courbe représentant une transformation adiabatique dans un diagramme thermodynamique[3].
Un corps qui laisse passer la chaleur est dit « diathermane », « diatherme » ou « diathermique »[4],[7],[8],[9],[10]. Le terme « diabatique » est parfois utilisé, particulièrement en météorologie[11],[12],[13],[14].
Processus adiabatique
Le premier principe de la thermodynamique énonce que l'énergie est conservée. Pour un système physique macroscopiquement au repos (la variation d'énergie cinétique est nulle), la variation d'énergie interne du système est égale à l'énergie échangée avec le milieu extérieur. Cet échange peut se faire de façon ordonnée par le travail de forces (transfert d'énergie mécanique) ou désordonnée par transfert thermique de chaleur (transfert d'énergie d'agitation thermique). Pour une transformation élémentaire (c'est-à-dire donnant lieu à une petite variation des paramètres décrivant le système), on a alors :
avec :
- la variation d'énergie interne ;
- le transfert thermique élémentaire au cours de la transformation (transfert de chaleur) ;
- le travail élémentaire des forces agissant sur le système durant la transformation.
Un processus adiabatique est par conséquent une transformation sans aucun transfert thermique, soit . La variation d'énergie interne du système est égale au seul transfert d'énergie mécanique par le travail des forces appliquées sur le système[15] :
Processus isentropique, réversibilité
Le deuxième principe de la thermodynamique introduit l'entropie définie par l'inégalité de Clausius :
avec la température absolue.
La transformation est[16] :
- réversible si ;
- irréversible si .
La différentielle de l'énergie interne s'écrit alors :
Le terme peut être dû à une réaction chimique ou un travail de force irrécupérable, comme celui des forces de frottements ou de viscosité dissipé en chaleur.
Un processus isentropique est une transformation dans laquelle l'entropie ne varie pas, soit . On peut établir que[16],[17] :
- un processus isentropique et réversible est adiabatique : on a et d'où ;
- un processus isentropique et irréversible n'est pas adiabatique : on a et d'où ;
- un processus adiabatique et réversible est isentropique : on a et d'où ;
- un processus adiabatique et irréversible n'est pas isentropique : on a et d'où .
Il n'y a par conséquent pas d'équivalence entre les termes « adiabatique » et « isentropique ». Une transformation n'est à la fois adiabatique et isentropique que si elle est réversible[17].
Application aux gaz parfaits
Cas général
Pour un gaz parfait soumis uniquement à des forces de pression dans une transformation adiabatique réversible, on a :
avec :
- la pression ;
- le volume.
La première loi de Joule énonce que l'énergie interne d'un gaz parfait ne dépend que de la température :
avec :
On obtient[18] :
Loi de Laplace
La loi des gaz parfaits et la relation de Mayer :
donnent :
avec :
- la capacité thermique isobare ;
- la quantité de matière ;
- la constante universelle des gaz parfaits ;
- l'indice adiabatique, ou coefficient de Laplace.
En considérant et comme des constantes, on différentie :
Par conséquent, étant donné l'expression générale obtenue pour les processus adiabatiques des gaz parfaits :
En considérant comme constant, on obtient par intégration la loi de Laplace[19],[20] :
La constante étant supérieure à 1, une transformation adiabatique réversible fait varier la pression dans le sens inverse du volume : la pression augmente lorsque le volume diminue.
En combinant la loi de Laplace avec la loi des gaz parfaits, on obtient d'autres formulations de la loi d'évolution adiabatique réversible.
Une transformation adiabatique réversible fait varier la pression dans le même sens que la température : la pression augmente lorsque la température augmente.
Une transformation adiabatique réversible fait varier le volume dans le sens inverse de la température : la température augmente lorsque le volume diminue.
Pour un gaz parfait monoatomique, tels les gaz rares (argon, etc.), à toute température. Pour un gaz diatomique (azote et oxygène, les principaux composants de l'air) dans les conditions normales de température et de pression (CNTP) .
Travail d'un gaz lors d'une compression adiabatique réversible

Le travail produit par le processus adiabatique, entre un état initial et un état final , vaut :
d'où, en considérant comme constant[21] :
avec :
- , et les pression, volume et température initiaux ;
- , et les pression, volume et température finaux ;
- pour un gaz parfait.
Le travail ainsi calculé représente la variation d'énergie interne du gaz[20]. Le milieu extérieur au gaz récupère le travail .
Autres applications
Efficacité énergétique d'un processus adiabatique
L'efficacité énergétique est définie comme le rapport entre le travail fourni par le système et l'énergie utilisée pour fournir ce travail.
Dans un processus adiabatique, par définition, la variation d'énergie interne du système est égale au seul transfert d'énergie mécanique par le travail de forces appliquées sur le système, car les transferts thermiques sont nuls, d'où :
Ceci revient à dire que l'efficacité énergétique d'un processus adiabatique est par définition de 100 %, ou bien qu'il n'y a aucune perte ni aucune addition d'énergie thermique durant le processus adiabatique. Ceci suppose en particulier qu'il n'y ait aucun frottement ou aucune viscosité, forces dont le travail irrécupérable dissipe de l'énergie sous forme de chaleur. Un processus adiabatique est donc un cas idéal.
Cycle de Carnot
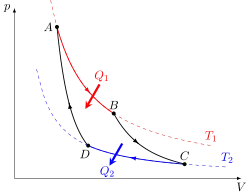
* AB : détente isotherme ;
* BC : détente adiabatique ;
* CD : compression isotherme ;
* DA : compression adiabatique.
Un moteur thermique est un dispositif permettant d'échanger du travail et une quantité de chaleur avec un milieu extérieur. Cet échange se fait par un cycle répété de nombreuses fois. Il se produit une série de transformations thermodynamiques dont certaines sont adiabatiques.
Par exemple, le cycle de Carnot correspond à un ensemble de deux transformations adiabatiques et deux transformations isothermes. Durant ce cycle, le gaz subit, dans l'ordre : une détente isotherme réversible, une détente adiabatique réversible (donc isentropique), une compression isotherme réversible et une compression adiabatique réversible (donc isentropique)[22].
Refroidissement adiabatique
Le refroidissement adiabatique est une méthode de rafraîchissement d'air basée sur l'évaporation de l'eau. Cette technique est aussi appelée « bioclimatisation », « rafraîchissement d'air par évaporation » ou « climatisation naturelle ».
L'air chaud et sec qui passe à travers un aérosol d'eau induit une évaporation partielle de celle-ci. L'énergie nécessaire à l'évaporation de l'eau est extraite de l'air, qui est ainsi refroidi et humidifié. Si l'on excepte l'eau pulvérisée qui doit alimenter un tel système, la seule énergie consommée est le travail du ventilateur nécessaire à la circulation de l'air à travers le flux d'eau[23],[24],[25].
Notes et références
Notes
- Définitions lexicographiques et étymologiques de « adiabatisme » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- « Adiabatique », dictionnaire Larousse.
- Définitions lexicographiques et étymologiques de « adiabatique » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- Infelta et Graetzel, p. 3.
- Commission d’enrichissement de la langue française, « adiabatique », FranceTerme, Ministère de la Culture (consulté le ).
- Commission d’enrichissement de la langue française, « adiabatique », FranceTerme, Ministère de la Culture (consulté le ).
- Définitions lexicographiques et étymologiques de « diatherme » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- « Diatherme », dictionnaire Larousse.
- Commission d’enrichissement de la langue française, « diathermane », FranceTerme, Ministère de la Culture (consulté le ).
- Commission d’enrichissement de la langue française, « diatherme », FranceTerme, Ministère de la Culture (consulté le ).
- G. Oscar Villeneuve, Glossaire de météorologie et de climatologie, Presses Université Laval, coll. « Choronoma Series », , 680 p. (ISBN 9782763768960, lire en ligne), p. 359.
- Météo-France La Réunion, « Adiabatique (transformation) », sur meteofrance.re (consulté le ).
- Météo-France La Réunion, « Diabatique », sur meteofrance.re (consulté le ).
- TV5MONDE, « Diabatique », sur langue-francaise.tv5monde.com (consulté le ).
- Faverjon, p. 85.
- Infelta et Graetzel, p. 36.
- Infelta et Graetzel, p. 38-40.
- Infelta et Graetzel, p. 47.
- Infelta et Graetzel, p. 48.
- Faverjon, p. 85-86.
- Faverjon, p. 86.
- Infelta et Graetzel, p. 33-34.
- Alain Garnier, Le bâtiment à énergie positive : Comment maîtriser l'énergie dans l'habitat ?, Éditions Eyrolles, coll. « L'efficacité énergétique du bâtiment », , 296 p. (ISBN 9782212162110, lire en ligne), p. 176.
- Jack Bossard, Christian Feldmann et Jean Hrabovsky, Pratique de la climatisation : en 24 fiches-outils, Dunod, , 264 p. (ISBN 9782100813155, lire en ligne), p. 120 (fiche n°13 - rafraîchissement adiabatique).
- Manfred Hegger, Construction et énergie : architecture et développement durable, PPUR Presses polytechniques, , 280 p. (ISBN 9782880747961, lire en ligne), p. 130.
Bibliographie
- Pierre Infelta et Michael Graetzel, Thermodynamique : Principes et Applications, Boca Raton, Floride, BrownWalker Press, , 484 p. (ISBN 1-58112-995-5, lire en ligne).
- Georges Faverjon, Thermodynamique MPSI, Editions Bréal, coll. « Les Nouveaux précis Bréal », , 192 p. (ISBN 9782749502304, lire en ligne).
Articles connexes
- Chaleur (thermodynamique)
- Compression adiabatique
- Gradient thermique adiabatique
- Loi de Laplace (thermodynamique)
- Processus isentropique
- Processus thermodynamique
- Réversibilité thermodynamique
- Portail de la physique
- Portail de l’énergie