Aigle ravisseur
Aquila rapax

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Classe | Aves |
| Ordre | Accipitriformes |
| Famille | Accipitridae |
| Genre | Aquila |
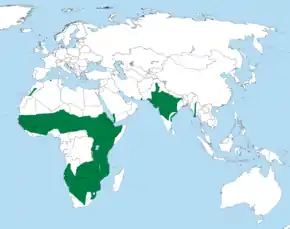
Répartition géographique

VU : Vulnérable
Statut CITES
L'Aigle ravisseur (Aquila rapax) est une espèce de rapaces diurnes de la famille des Accipitridae. Ses pattes largement garnies de plumes le désignent comme membre de la sous-famille des Aquilinae ou « aigles bottés »[1]. L'aigle ravisseur a une distribution géographique large mais discontinue ; il se reproduit en Afrique et en Asie tropicale où il privilégie les habitats ouverts et secs tels que : désert, semi-désert, steppes et savane[2]. Malgré cette préférence pour les zones arides, l'espèce se retrouve rarement dans les territoires entièrement dépourvus d'arbres[3]. L'aigle ravisseur est sédentaire et pond de un à trois œufs dans un nid de brindilles situé généralement à la cime d'un arbre[4]. C'est probablement le plus opportuniste de tout son groupe taxonomique, ayant souvent recours à la consommation de charognes ou au cleptoparasitisme d'autres espèces carnivores (d'où son nom de « ravisseur »), mais c'est aussi un prédateur très actif qui choisit souvent des proies relativement grandes et diverses[5]. On estime que cet aigle peut vivre jusqu'à 16 ans[6] ; cependant, on observe un déclin rapide de l'espèce à de nombreux endroits de sa zone de distribution. Les raisons sont nombreuses, particulièrement la perte de son habitat due à l'abattage d'arbres, au réchauffement climatique, ainsi que les persécutions humaines, notamment par empoisonnement, et plus généralement la présence humaine, notamment les collisions avec des structures artificielles ; pour toutes ces raisons, l'aigle ravisseur est peut-être en danger d'extinction[7],[6],[8].
Taxonomie

Le naturaliste hollandais Coenraad Jacob Temminck a décrit l'aigle ravisseur en 1828 d'après un spécimen-type indien[9]. Le nom vernaculaire de l'espèce est « aigle ravisseur » en français, et « tawny eagle » (aigle fauve) en anglais[10] ; le nom latin, Aquila, désigne l'aigle, et rapax signifie « attraper » et est également à l'origine du mot « rapace »[4],[11],[12]. L'aigle ravisseur appartient à la sous-famille des Aquilinae ou « aigles bottés »[2] ; cette sous-famille est monophylétique, et l'étude de leurs caryotypes indique qu'ils ont peu de liens avec le reste de la famille des Accipitridae[1],[13],[14]. La sous-famille des Aquilinae se distingue par des plumes couvrant leurs pattes, et elle se retrouve sur tous les continents où les Accipitridae existent[5].
Le genre Aquila est traditionnellement défini comme celui des aigles au plumage sombre, de taille moyenne à grande, aux longues ailes et vivant dans des zones ouvertes[15] ; cependant, des études génétiques ont conduit à des reclassifications. Des aigles plus petits, plus pâles et vivant dans des milieux forestiers ont été reclassés dans le genre Aquila, le genre Clanga a été séparé et certains petits aigles ont été reclassés dans le genre Hieraaetus. Ces études ont également révélé un écart entre des aigles apparemment similaires : d'un côté l'aigle ravisseur et ses espèces proches, de l'autre le complexe d'espèces de l'aigle royal (Aquila chrysateos). De nos jours, le complexe d'espèces de l'aigle ravisseur et celui de l'aigle royal sont encore classés dans le même genre, bien qu'il ne semble pas y avoir de lien proche entre eux[1],[15],[16],[17].
On a d'abord considéré que l'aigle ravisseur et l'aigle des steppes (Aquila nipalensis) étaient la même espèce[5],[18], jusqu'en 1991[19]. Les deux espèces ont ensuite été séparées sur la base de différences notables dans leur anatomie et leur morphologie. L'aigle des steppes est plus grand, l'intérieur de son bec est plus visible, et son apparence diffère par une charpente plus trapue, de plus grandes ailes et des différences de coloration à tous les stades du développement, même si certaines variantes des deux espèces présentent des ressemblances[20],[21],[22],[23],[24]. De plus, les deux espèces diffèrent du point de vue écologique, n'ayant pas le même régime alimentaire ni les mêmes habitudes de nidification, et sont allopatriques dans leurs aires de répartition[4],[20]. Deux études moléculaires basées sur un petit nombre de gènes indiquent que les deux espèces sont différentes, mais ne sont pas d'accord sur leur proximité génétique[25],[26] . Génétiquement, l'aigle ravisseur pourrait être plus proche du complexe d'espèces de l'aigle impérial, même si l'aigle des steppes est sympatrique avec ces derniers[1].
Sous-espèces
.jpg.webp)
D'après Alan P. Peterson, cette espèce est constituée de trois sous-espèces. Le classement de ces sous-espèces est compliqué par l'existence de variations et de formes différentes, et il a été d'abord considéré comme provisoire[2]. Cependant, chaque sous-espèce est largement allopatrique par rapport aux autres, les seules ambiguités se trouvant au nord-est de l'Afrique, où deux sous-espèces peuvent cohabiter[27].
- A. r. rapax (Temminck, 1828) : du sud du Kenya, la RDC à l'Afrique du Sud[2]. Cependant, cette sous-espèce peut se trouver jusqu'en Éthiopie (et interagir avec la sous-espèce A. r. belisarius qui habite aussi l'Afrique du Nord)[28]. Les adultes de cette sous-espèce sont plus roux et ont parfois des striures sombres sur le ventre. Les juvéniles sont d'un roux plus clair. La mesure de l'aile pliée de cette sous-espèce est de 485 mm à 540 mm pour les mâles, et entre 509 mm et 565 mm pour les femelles[2]. Dans deux échantillons de cette sous-espèce, les mesures moyennes de l'aile pliée étaient de 501 mm et 512 mm pour les mâles, de 541 mm et 545 mm pour les femelles[5],[29]. Pour les deux sexes, la longueur de la queue varie entre 245 mm et 295 mm, et la longueur des tarses entre 79 mm et 92 mm. Dans un échantillon de 36 aigles, la masse était comprise entre 1,6 kg et 3,1 kg[2].
- A. r. belisarius (Levaillant, J, 1850) : du Maroc, l'Algérie et le sud de la Mauritanie à l'Éthiopie et le sud-ouest de la péninsule Arabique à la RDC, l'Ouganda et le Kenya[2],[30]. Cette sous-espèce est décrite comme ayant l'air plus « nette » que la sous-espèce principale, probablement parce qu'à cause de son habitat plus désertique, elle a un plumage plus compact[2],[31]. Comparée à la sous-espèce principale, cette sous-espèce est souvent plus brune et plus terne, avec des nuances moins rousses. Les formes pâles d'A. r. belisarius sont souvent un peu plus sombres que les formes pâles de la sous-espèce principale, mais pas toujours. Bien qu'on la dise un peu plus grande, les mesures montrent que cette sous-espèce a des mensurations comparables à celles de la sous-espèce principale. Pour les mâles, la mesure de l'aile pliée varie entre 495 mm et 535 mm, et pour les femelles entre 500 mm et 562 mm[2]. La mesure moyenne de l'aile pliée est de 515 mm pour les mâles et de 525 mm pour les femelles, ce qui montre que le dimorphisme sexuel n'est pas très prononcé chez cette sous-espèce[5]. Un mâle a été pesé à 2 kg, trois femelles entre 1,9 kg et 2,5 kg[2],[5].
- A. r. vindhiana (Franklin, 1831) : Asie à l'exclusion de la péninsule arabique, particulièrement l'Iran et le sous-continent indien[4]. Il y a cependant des ambiguïtés sur la distribution de cette sous-espèce et de A. r. belisarius, notamment au Moyen-Orient[32],[33]. Il est parfois suggéré que cette sous-espèce pourrait être une espèce à part entière[34]. Cette sous-espèce est plus sombre que les deux autres et généralement moins rousse ; sa coloration est très similaire à celle de l'aigle des steppes[2]. Les iris d'A. r. vindhiana sont parfois bruns, ce qui est également le cas chez l'aigle des steppes. La forme pâle de cette sous-espèce est plus grise et moins rousse que les formes pâles des sous-espèces africaines, mais les juvéniles et les immatures sont souvent roux. Cela pourrait être la plus petite des trois sous-espèces, mais il y a peu de différences au sein de l'espèce. La mesure de l'aile pliée varie entre 473 mm et 535 mm chez les mâles, et entre 510 mm et 560 mm chez les femelles[2],[35],[36]. Chez les mâles, la mesure moyenne de l'aile pliée est de 495 mm, et de 525 mm chez les femelles[5]. La longueur de la queue des mâles vraie entre 242 mm et 258 mm, et celle des femelles entre 242 mm et 285 mm. La longueur des tarses des mâles varie entre 80 mm et 87 mm, celle des femelles entre 84 mm et 91 mm[35],[36]. Des adultes au sexe non déterminé ont été pesés entre 1,5 kg et 2,1 kg en Inde[4].
Description

L'aigle ravisseur est décrit comme « peu élégant et à l'air ébouriffé », mais il a une silhouette aquiline plutôt caractéristique[2]. Il possède un cou assez long, et un bec long et profond, dont l'ouverture va jusqu'au niveau de l'œil, des ailes modérément longues avec des « doigts » assez prononcés, et une queue peu arrondie, presque carrée, qui ressemble plus à celle d'un vautour que celles d'autres espèces d'aigles. Le plumage de ses pattes est important, et peut avoir l'air épais[2],[11],[37]. La tête et le bec sont forts et épais, le corps est bien proportionné et les pieds puissants, ce qui lui donne une allure féroce[11]. L'aigle ravisseur se perche bien droit, généralement sur des souches, des poteaux ou des arbres, pendant une longue période de la journée, et quand il descend, il marche avec une allure un peu maladroite et une posture plus horizontale. Quand il est perché, le bout de ses ailes coïncide à peu près avec le bout de sa queue[2].
Les adultes ont des yeux de différentes couleurs, variant du jaune au brun-jaune en passant par le brun pâle, ceux des juvéniles sont brun foncé. Les pieds et la cire du bec sont jaunes à tous les âges[2]. L'aigle ravisseur est très polymorphe, avec des variations très importantes du plumage entre individus, qui peuvent porter à confusion[2],[4]. Chez les adultes, la coloration du plumage peut varier d'un gris-brun sombre à un roux strié (ou plus uni) ou jaunâtre[2],[38] ; cependant la plupart des adultes sont gris-brun ou roux-fauve, parfois avec des taches plus claires au niveau de la nuque et du ventre, avec les couvertures d'une couleur uniforme identique au corps[4]. La nuque est toujours sombre, même si le bout des plumes est plus pâle, contrairement au plumage plus pâle observé chez d'autres espèces du genre Aquila[4]. Les femelles, en plus d'être un peu plus grandes que les mâles, sont souvent aussi un peu plus sombres et plus striées[2]. Les individus d'un brun sombre se trouvent généralement en Inde et appartiennent à la sous-espèce A. r. vindhiana[2],[4]. Les adultes montrent peu de variations de couleurs, à part que les plumes des ailes et de la queue sont plus sombres, mais quand ils viennent de muer, les grandes couvertures et les couvertures secondaires peuvent présenter des bouts plus pâles qui forment des lignes plus claires sur l'aile repliée[2]. La tête est généralement de la même couleur fauve que le corps, mais peu présenter des sourcils sombres, de petites striures brunes ou un menton plus sombre[2]. La queue est soit unie, soit rayée de zones plus sombres, généralement avec 7 rayures. La forme sombre adulte est d'un brun sombre ; certains individus peuvent présenter des striures irrégulières et des plumes plus noires[2]. La forme intermédiaire est d'un brun roux sur le dos, les couvertures des ailes sont variablement striées, d'un roux plus clair, ainsi que la tête, dont le haut ou les côtés sont plus pâles. Le ventre de la forme intermédiaire est généralement roux (en particulier au sud de l'Afrique), avec la poitrine et les flancs largement striés de brun sombre, mais qui peuvent apparaître entièrement bruns, en contraste avec les jambes unies[2]. La forme pâle adulte montre toujours un fort contraste entre un corps clair et des couvertures d'ailes dotées de rémiges sombres et une queue sombre. Dans cette forme pâle, le dessous des ailes est roux clair ou brun fauve clair, puis les petites et moyennes couvertures sont plus sombres, pour finir avec des rémiges presque noires. La tête peut aussi être de couleur fauve, mais peut présenter des striures brunes ou un menton plus sombre. Le ventre est roux clair ou brun clair, parfois plus pâle en-dessous du ventre. Chez les individus âgés ou malades de cette forme pâle, les plumes du corps peuvent apparaître presque blanches[2].
_juvenile_(16715544215).jpg.webp)
Les juvéniles de la forme sombre sont roux clair ou roux-brun, avec le bas du dos et le haut de la queue crème. Les grandes couvertures et les rémiges sont brun sombre avec des taches pâles, la queue est rayée de gris et de brun, souvent avec le bout crème. Ils peuvent devenir plus pâles avant de changer de plumage. Les autres stades sont moins bien connus, mais il semble qu'au stade subadulte, les aigles de forme sombre deviennent graduellement brun sombre ou brun-roux sur le haut du dos, ainsi qu'au niveau de la tête et du haut de la poitrine, tandis que le reste garde la même couleur. Les autres formes semblent similaires, mais elles sont mal connues, et des variations peuvent apparaître selon les individus. Beaucoup sont roux ou de couleur sable après la mue, mais changent de couleur par la suite ; la proportion de plumes pâles pourrait indiquer la forme prise au stade adulte[2].
En vol, l'aigle ravisseur apparaît comme un grand rapace avec un long cou, avec une poitrine puissante, et des ailes longues et larges, mais un peu plus étroites au niveau des doigts[2]. Le bord des ailes est légèrement courbé vers l'extérieur, en particulier à la jonction des primaires et des secondaires, tandis que la queue, arrondie et de longueur moyenne, est généralement portée étalée[11]. Les larges battements des ailes peuvent faire paraître le vol de l'aigle ravisseur lourd et lent, mais ses mouvements d'ailes sont plus rapides et étendus et ont souvent l'air moins forcés que ceux d'autres espèces plus grandes du genre Aquila comme l'aigle des steppes, ce qui rend l'aigle ravisseur très rapide et agile quand il tente de voler les proies d'autres rapaces[2],[4]. L'aigle ravisseur vole avec les ailes plates, ou légèrement relevées avec les bouts légèrement abaissés, et peut planer de la même manière, mais arque ses ailes pour planer plus rapidement[2].
Les adultes de la forme sombre sont d'un brun à peu près uniforme sur le dessus et le dessous, avec des plumes primaires plus pâles et plus grises sur les côtés. Sur le dessus, l'endroit qui contraste le plus sur la forme sombre est la tache plus claire en bas du dos, et sur le dessous, la couleur grise est contrastée par des bouts plus noirs et une ligne diffuse au bout des ailes et de la queue. Les aigles de la forme intermédiaire sont roux strié de brun ou brun-roux sur le dos et les couvertures des ailes, avec le bas du dos plus pâle comme pour la forme sombre. Sur le dessous, les striures sombres de la forme intermédiaire sont plus subtiles et leur couleur peut sembler presque uniforme. Les plumes des ailes de la forme intermédiaire sont souvent plus grises, avec un contraste plus important entre les plumes primaires pâles et les plumes plus noires du bout des ailes. La forme pâle est rousse ou jaune pâle des deux côtés des ailes, ce qui contraste fortement avec le brun sombre au bout des grandes couvertures, sur les plumes au bout des ailes et de la queue et souvent les scapulaires. Les primaires sont également pâles. Certains adultes ont des bases pâles sous les primaires, et les plumes peuvent être unies, mais généralement elles ont des rayures sombres étroites[2],[4].
Les juvéniles de la forme sombre sont roux ou fauve clair sur le dessus, ce qui contraste fortement avec le brun sombre des grandes couvertures, des scapulaires, des rémiges et de la queue, ainsi qu'avec la couleur crème du bas du dos. Sur le dessous, ces juvéniles peuvent ressembler aux adultes de la forme pâle, à part que le bout des plumes est blanchâtre, et qu'ils ont parfois des diagonales pâles irrégulières au bout des grandes couvertures, mais ces dernières disparaissent rapidement pendant la croissance. On connaît mal l'évolution de leur plumage, mais ces juvéniles muent pour devenir bruns, et sont tachetés dans l'intervalle, souvent avec une à trois barres plus sombres sur le bord des ailes[2]. Le dessous des subadultes (entre 2 et 3 ans) est typiquement contrasté avec un brun plus sombre sur la poitrine, le ventre et le dessous des ailes, et le reste est plutôt crème. Ce motif bicolore existe chez les aigles ravisseurs d'Inde et d'Afrique[4],[39]. L'aigle ravisseur obtient son plumage adulte entre 4 et 5 ans[2].
Taille
_(17256874720).jpg.webp)
L'aigle ravisseur est un rapace assez grand, mais un petit aigle : il est l'un des plus petits représentants du genre Aquila. Il est à peu près de la même taille que l'aigle de Bonelli (Aquila fasciata) mais avec des ailes plus longues, il est un peu plus grand que l'aigle fascié (Aquila spilogaster), et notablement plus grand que l'aigle de Cassin (Aquila africanus). Les femelles des plus grandes espèces du genre Aquila sont généralement deux fois plus lourdes que la moyenne de l'aigle ravisseur[40]. Comme c'est souvent le cas chez les rapaces, la femelle est plus grande que le mâle, mais la différence est assez faible, de l'ordre de 15 %[2]. Il mesure entre 58 cm et 75 cm[4],[41] ; 65 cm est considéré comme la taille typique d'un aigle ravisseur[42]. Son envergure atteint 157 cm à 190 cm. Le poids d'un aigle ravisseur adulte varie entre 1,5 kg et 3,1 kg[2],[4],[43]. Une étude a indiqué un poids moyen de 1,91 kg chez 5 mâles et de 1,97 kg chez 5 femelles[29]. Dans une autre étude, 10 aigles au sexe indéterminé pesaient en moyenne 2,5 kg, et sur un échantillon de 15 aigles, l'envergure moyenne était de 182,9 cm[44]. Sur un autre petit échantillon d'aigles en Afrique, 4 mâles avaient un poids moyen de 1,85 kg et 3 femelles un poids moyen de 2,28 kg[5]. Une autre étude a estimé le poids moyen de l'espèce à 2,3 kg[45]. En combinant toutes les mesures, l'aile pliée varie entre 473 mm et 565 mm, la longueur de la queue entre 242 mm et 295 mm, et celle des tarses de 79 mm à 92 mm[2],[46]. Les mesures du culmen des aigles ravisseurs du Kenya varient entre 33,3 mm et 42,4 mm avec une moyenne de 37,7 mm, tandis que la taille moyenne de l'ouverture du bec est de 44 mm, avec des variations entre 40,3 mm et 49,9 mm[20],[47]. La grande serre de l'hallux, qui sert souvent à tuer chez les Accipitridae, mesure entre 27 mm et 37,7 mm, pour une moyenne de 31,8 mm dans un des échantillons et de 32,3 mm dans un autre. Cette serre n'est pas spécialement large par rapport aux autres représentants de cette sous-famille, et est proportionnellement similaire en taille à celle de l'aigle des steppes et de l'aigle impérial[5],[20],[47].
Confusion entre espèces

L'aigle ravisseur vit dans des zones où vivent également d'autres rapaces de taille similaire, et avec un plumage brun du même type. L'identification est donc rarement évidente[48],[49]. Comparativement à l'aigle des steppes, une espèce proche (autrefois considérée comme la même espèce) qui a les mêmes zones d'hivernage, il est à la fois plus petit et plus trapu, une forme d'ailes différente, une tête plus grosse avec une base de bec plus forte, un iris plus pâle. L'aigle des steppes a également une queue plus longue et plus arrondie. De plus, l'aigle des steppes a des barres plus épaisses et plus espacées sur les ailes que l'aigle ravisseur, ainsi qu'un bord des ailes plus sombre et une gorge plus pâle[2],[20],[49],[38],[50].
En-dehors de l'aigle des steppes, l'aigle ravisseur peut aussi être comparé avec divers autres représentants sympatriques de sa sous-famille. Par rapport aux aigles du genre Clanga, il a une queue plus longue, un bec plus proéminent, des ailes souvent d'apparence moins carrée, un cou plus long, et une allure globalement plus longiligne, même si la taille est similaire. Par rapport à l'aigle impérial, les ailes de l'aigle ravisseur sont plus larges avec des bords moins réguliers, le bec est un peu moins proéminent et les ailes se tiennent généralement plus hautes, et le corps de l'aigle ravisseur est plus petit. Par rapport au complexe d'espèces de l'aigle royal, dans lequel seuls l'aigle royal et l'aigle de Verreaux sont comparables à l'aigle ravisseur, ce dernier est largement plus petit, les ailes sont rarement portées en dièdre marqué, et à proportion, le bec est bien plus long et la queue un peu plus courte[1],[4]. L'aigle criard (Clanga clanga), comme l'aigle des steppes, se reproduit dans l'écozone paléarctique et hiverne fréquemment aux même endroits que l'aigle ravisseur. Par rapport à ce dernier, il a une queue un peu plus courte et large, les plumes des pattes moins ébouriffées, et son plumage adulte est généralement plus sombre et plus uni[2]. La forme beige clair dite fulvescens de l'aigle criard se distingue de la forme pâle de l'aigle ravisseur par les motifs sous les ailes, souvent avec des couvertures plus sombres sous les ailes, des rémiges sombres souvent unies au niveau des primaires, et des arcs pâles visibles au niveau des carpes[2],[51]. L'aigle pomarin (Clanga pomarina) est plus petit et plus compact que l'aigle ravisseur, avec un U blanc distinctif au-dessus de la queue[2],[51]. L'aigle de Wahlberg (Hieraeetus wahlbergi) qui vit en Afrique peut avoir un plumage similaire à celui de l'aigle ravisseur, mais avec des rémiges plus grises, et il est bien plus petit que l'aigle ravisseur, avec des ailes plus longues et plus rectangulaires, et une queue plus longue, plus étroite et avec le bout plus droit[2],[51]. L'aigle impérial juvénile peut sembler similaire aux formes pâles et intermédiaires de l'aigle ravisseur, mais l'aigle impérial est visiblement plus grand, avec des ailes plus longues et plus étroites, une queue plus longue et plus large, ainsi que des striures brun foncé sur la poitrine, le dos et les couvertures des ailes, et il a des barres pâles sur le bout des ailes[2],[38]. Les aigles ravisseurs plus foncés d'Inde se distinguent des aigles noirs (Ictinaetus malaiensis), de taille similaire, car ces derniers son plus minces avec des ailes plus longues, plus sombres, avec une base plus étroite, et une queue plus longue, plus étroite et distinctement rayée[2]. D'autres rapaces plus différents comme les circaètes, par exemple le circaète brun (Circaetus cinereus), le circaète à poitrine noire (Circaetus pectoralis), ou le juvénile du bateleur des savanes (Terathopius ecaudatus), sont parfois mentionnés comme pouvant être confondus avec les aigles ravisseurs, mais se distinguent généralement bien car ils ont tous une plus grosse tête, un plus petit bec, une queue plus courte, les pattes nues et un plumage moins uniforme, même avec des couleurs similaires[11],[51].
Cris
.jpg.webp)
L'aigle ravisseur est généralement silencieux sur toute sa distribution géographique[2]. Cependant, contrairement à l'aigle des steppes qui est extrêmement silencieux en-dehors de sa zone de reproduction, l'aigle ravisseur se fait entendre occasionnellement tout au long de l'année[38]. Il est également plus bruyant que les aigles du genre Clanga hors de la période de reproduction[2]. Son cri habituel est un aboiement puissant et sourd, transcrit selon les sources en kowk-kowk, kau-kau, kiok-kiok, ki-ark... Le cri est plutôt aigu (un peu plus que celui de l'aigle des steppes en période de reproduction) mais plus grave que celui des aigles Clanga[2]. Dans le parc national Kruger en Afrique du Sud, son cri est réputé puissant et s'entend de loin[11]. Les mâles sont ceux qui crient le plus souvent, particulièrement lors des ballets aériens, mais aussi en d'autres occasions, comme les disputes pour la nourriture, les dérangements du nid et pour attirer les femelles[2]. En neuf ans de surveillance des aigles ravisseurs au Zimbabwe, cependant, aucun cri n'a jamais été entendu ; ce silence pourrait être lié à la différence de terrain, celui du Zimbabwe est plat[52]. Des études indiquent également d'autres cris comme un k eke ke dur pendant les parades aériennes, et un kra guttural pendant les poursuites de cleptoparasitisme. L'aigle ravisseur peut aussi émettre un kra-kra destiné à avertir les intrus[2],[4]. La femelle peut parfois émettre une sorte de miaulement shreep-shreep au nid, ou de grands cris, le premier étant peut-être pour réclamer à manger, les seconds pour alerter[2],[4],[53]. L'aiglon commence par pépier, mais une fois que ses plumes ont poussé, il utilise un grand cri we-yik, wee-yik pour réclamer à manger[11].
Distribution et habitat
L'aire de répartition naturelle de l'aigle ravisseur est très étendue. La population africaine est partagée en trois populations différentes et relativement discrètes[2]. La première se trouve dans le nord de l'Afrique, dont le sud du Maroc, le nord de l'Algérie, le sud-ouest de la Mauritanie, la Sénégambie, le sud du Mali, le centre et le sud du Niger, le sud du Tchad, le nord et le centre du Soudan, l'Éthiopie et la Somalie (principalement à l'est et au nord-est)[7],[2],[28],[54],[55],[56],[57]. La population nord-africaine est clairsemée. Au Maroc, les aigles ravisseurs sont peu nombreux, et il reste quelques populations dans les régions de Tarfaya, Tan-Tan et Souss-Massa[58]. Ces populations proviennent peut-être de Tunisie où l'aigle ravisseur était autrefois répandu[59]. En Afrique de l'Ouest, on trouve quelques aigles ravisseurs en Gambie au Togo, au Nigeria et (même s'il ne s'y reproduit pas forcément) en Côte d'Ivoire et au Ghana[60],[61],[62],[63],[64],[65],[66]. Dans le centre et l'est de l'Afrique, l'aigle ravisseur se trouve au centre et à l'est de la République démocratique du Congo, dans les zones sèches de l'Ouganda, et partout au Kenya, en Tanzanie, en Zambie (souvent près de la rivière Luangwa et du Chambeshi), au Malawi et au Mozambique. En Afrique de l'Est, cette espèce est considérée comme l'aigle brun le plus répandu et le plus régulièrement observé[67],[68],[69],[70]. Dans le sud du continent, l'aigle ravisseur peut être vu au Zimbabwe (mais il s'y raréfie, à part dans le Matabeleland et la région de Chipinge), au Botswana (on peut le voir régulièrement dans le delta de l'Okavango), dans certaines régions de Namibie, au sud et à l'ouest de l'Angola (dans les provinces de Cuando-Cubango, Cunene, Huíla, Namibe et Malanje), l'Eswatini, le Lesotho et le nord et le centre de l'Afrique du Sud, en particulier au nord du fleuve Orange mais parfois aussi dans la province du Cap[7],[11],[71],[72],[73],[74],[75],[76],[77],[78]. La dernière reproduction d'aigle ravisseur au Swaziland a été observée en 2001 ; depuis, il est possible qu'il ne s'y reproduise plus[79].
En-dehors de l'Afrique, l'aigle ravisseur peut aussi se trouver sur la péninsule arabique, notamment au Yémen et au sud-ouest de l'Arabie saoudite, dans les provinces de Tihama et d'Asir, mais peu, voire pas de reproductions n'ont été observées au cours des dernières décennies[7],[80],[81]. L'aigle ravisseur est considéré comme rarement de passage en Israël : si certaines observations ont été confirmées, d'autres résultaient d'une mauvaise identification de l'aigle des steppes[82]. Il est également observé à de rares occasions dans le sultanat d'Oman[83]. L'aigle ravisseur existe aussi sous formes de populations isolées dans le sud-est de l'Iran (comme pour l'Arabie, il n'y a pas de preuves qu'il s'y soit reproduit récemment), et de manière un peu plus continue dans l'est du Pakistan (en particulier dans la vallée de l'Indus), au nord et sur la péninsule de l'Inde, et de manière plus dispersée à l'est, au sud du Népal et dans l'Assam[2],[84],[85],[86]. Même s'il est rare d'observer l'aigle ravisseur au Népal, on pense que l'espèce y réside encore dans des zones semi-désertiques à basse altitude[87]. En Inde, la répartition de l'aigle ravisseur inclut le Pendjab, la plaine indo-gangétique, l'ouest du Bengale, le nord-est du Bihar, le plateau du Deccan, ainsi que l'Andhra Pradesh, le Karnataka et le nord du Tamil Nadu[4],[84],[88]. Des observations sporadiques d'aigles ravisseurs errants ont été faites au Myanmar, au nord du Vietnam et en Thaïlande, mais il s'agit probablement de confusions avec des aigles des steppes, ou des spécimens non identifiés[89]. Quelques observations d'aigles ravisseurs errants ont été confirmées au Sri Lanka, il s'agit de la seule espèce du genre Aquila observée dans ce pays[90]. D'autres observations ont été faites en Afghanistan mais restent à confirmer[84].
Habitat

L'aigle ravisseur occupe des habitats ouverts à diverses altitudes, mais préfère les zones plutôt arides. En Afrique de l'Ouest, il se reproduit entre les forêts et les savanes, mais se déplace vers des forêts plus sèches voire des zones semi-désertiques en-dehors des périodes de reproduction[2]. Au Maroc, l'espèce préfère les zones forestières entre montagnes et plaines. Dans d'autres régions d'Afrique, l'aigle ravisseur occupe les savanes, en particulier les zones riches en acacias, les zones semi-désertiques voire les déserts. Cependant, il évite les déserts extrêmes sans aucune végétation autant que les forêts tropicales humides. Il peut aussi occuper des zones aménagées par les humains, comme les terres arables, les bords de route, les barrages, les fermes, les prairies d'élevage, et même les zones de chasse si elles offrent des occasions de se nourrir[2],[28],[70],[74],[75],[91]. En Afrique du Sud, le veld est l'habitat préféré de l'aigle ravisseur, surtout s'il s'y trouve des acacias. Même si les climats y sont similaires, le miombo est moins apprécié et l'aigle ravisseur y est plus rare[11],[70],[74]. En Inde des habitats similaires peuvent être utilisés, mais l'aigle ravisseur est aussi largement présent autour des villages et des cultures. Il fréquente aussi les décharges publiques et les abattoirs, plus qu'en Afrique[2],[4],[84]. L'aigle ravisseur fréquente également les forêts d'épineux[4]. Il peut vivre entre le niveau de la mer et une altitude de 3 000 m, mais préfère les altitudes basses[2]. Bien qu'il préfère un certain niveau d'aridité dans son habitat, l'aigle ravisseur a certaines exigences pour choisir sa zone de nidification[3]. Sa présence peut être prédite par la présence d'averses durant la saison humide[3],[92],[93]. Cette dépendance aux averses est probablement la clé de la qualité de son habitat et de la présence de proies, mais aussi de la disponibilité de sites de nidification[11],[92]. L'aigle ravisseur fait son nid dans les arbres, si bien que les milieux trop arides pour que des arbres y poussent, ou dont les arbres sont victimes d'abattage massif, ne peuvent pas abriter cette espèce[4],[11],[94].
Comportement
_1.jpg.webp)
Contrairement à l'aigle des steppes, l'aigle ravisseur est largement sédentaire et ne migre pas. Cependant, en Afrique, il est considéré comme nomade, et peut effectuer des déplacements saisonniers[2],[95]. En Afrique de l'Ouest, la sous-espèce Aquila rapax belisarius voyage assez régulièrement sur de courtes distances vers des zones plus humides en octobre et en novembre, puis retourne vers le nord en avril, et parfois, migre vers le désert du Kalahari ou le Botswana, et peut aller jusqu'en Afrique du Sud[2],[62],[64],[96]. Parfois, des aigles ravisseurs sont observés voyageant plus ou moins régulièrement entre l'Éthiopie et l'ouest de l'Afrique[95]. Des déplacements plus longs ont été observés, dont un aigle de la sous-espèce A. r. belisarius qui a été vu en Tunisie, en Égypte (observé deux fois dans les années 1950), en Israël (trois observations en hiver dans les années 1990) et dans le sultanat d'Oman[2],[97],[98],[99]. À partir de l'Inde, il n'est pas rare de voir des aigles ravisseurs se déplacer vers le Bangladesh, probablement des juvéniles se dispersant, mais les observations de l'espèce allant jusqu'en Thaïlande et dans le sud-est de l'Asie sont maintenant considérées comme très douteuses[89],[100]. Dans le sud de l'Afrique, les aigles ravisseurs semblent rarement quitter leur zone de reproduction, et les juvéniles ne se dispersent pas à plus de quelques dizaines de kilomètres de leur nid d'origine[11],[101]. Un aigle ravisseur bagué au nid à Esigidini au Zimbabwe a été retrouvé à Fort Nixon, près de son lieu d'origine, deux ans plus tard[74] ; cependant, un autre aigle bagué au nid a été retrouvé à 330 km de son nid d'origine au Zimbabwe quatre ans plus tard, une dispersion lointaine pour le sud de l'Afrique[70]. Des mouvements d'aigles ravisseurs inconstants et imprévisibles ont été observés dans des études écologiques expérimentales, qui ont démontré qu'il s'agissait d'aigles à la recherche de nouveaux territoires pour éviter un manque de pluie[102].
Contrairement à l'aigle des steppes qui, en-dehors des périodes de reproduction, est sociable et peut se déplacer en groupe si les occasions de chasse le permettent, l'aigle ravisseur est généralement considéré comme solitaire[2],[4]. Des groupes de deux ou trois aigles peuvent cependant être observés sur le sous-continent indien, et il arrive parfois d'observer des groupes plus nombreux[4]. Dans l'Azad Cachemire au Pakistan, de petits groupes d'aigles ravisseurs ont été vus se rassemblant dans des endroits plus chauds entre novembre et février, pendant les trois ans de l'étude[103]. Des petits groupes ou des rassemblements existent aussi en Afrique là où la nourriture est concentrée, et des nidifications communales ont été observées dans des arbres, des pylônes électriques, ou au sol[2].
Comme beaucoup de grands rapaces, l'aigle ravisseur passe la plupart de ses journées perché, mais prend son envol plusieurs fois par jour[4],[11]. Contrairement à la plupart des grands aigles, il est habitué à la présence humaine, et se laisse approcher d'assez près par des observateurs, du moins en Inde[4],[104].
Régime alimentaire

L'aigle ravisseur est unique dans le genre Aquila par son manque apparent de spécialisation dans son alimentation : il se nourrit des proies capturées par d'autres oiseaux, d'où son nom, mais peut également chasser[2],[4],[11]. Alors que les autres espèces du genre Aquila ne le font qu'occasionnellement, l'aigle ravisseur se nourrit régulièrement de charognes, probablement tout au long de l'année, mais plus souvent en-dehors de la période de reproduction[4],[11]. Cela l'amène à fréquenter les décharges, les villages et les abattoirs, particulièrement en Inde, ainsi qu'à s'associer avec des vautours pour repérer des carcasses. Il se trouve souvent au bord des routes, où le trafic routier est une source régulière de nourriture[2],[4]. Il a aussi régulièrement recours au cleptoparasitisme d'autres rapaces, sûrement davantage que n'importe quelle autre espèce d'oiseaux de proie[4],[11]. Cependant, les descriptions de l'aigle ravisseur « paresseux », « pas très distingué » ou « peu impressionnant » ne sont pas très appropriées, car c'est aussi un très bon prédateur, capable de s'attaquer à un large éventail de proies, y compris des animaux très grands[11],[20]. La technique de chasse de l'aigle ravisseur consiste généralement à plonger depuis un perchoir, ou piquer depuis les airs[2]. Sur le sous-continent indien, les arbres utilisés comme perchoir pour la chasse sont le Vachellia nilotica, le Prosopis cineraria et le Capparis decidua[4]. L'aigle ravisseur peut aussi chasser en se déplaçant à terre. Il chasse essentiellement des proies terrestres, plus rarement arboricoles[2],[4],[11]. Cependant il peut aussi attraper des oiseaux en vol[4],[11]. Les oiseaux attrapés en vol ont des tailles très diverses, allant du pigeon roussard aux flamants[11]. L'aigle ravisseur chasse souvent en couple pendant la période de reproduction, ce qui lui permet d'attraper des proies plus grandes qu'en-dehors de la période de reproduction[4]. Cette chasse en couple peut même avoir lieu en toute saison[11]. L'un des oiseaux vole d'abord pour distraire la proie, puis l'autre arrive discrètement pour la tuer, comme cela a également été observé pour la chasse en couple d'autres rapaces[4],[11],[105]. Des animaux nocturnes comme des genettes ou des lièvres sauteurs ont été chassés par des aigles ravisseurs dans des zones où ils n'avaient pas pu être tués par le trafic routier. D'autres observations d'aigles buvant ou se baignant la nuit amènent à penser que l'espèce a un comportement nocturne résiduel, mais il n'y a pas encore de preuve irréfutable[11],[106]. La présence semi-régulière d'aigles ravisseurs près de feux de broussaille a été observée en Inde, probablement attendant de capturer des proies déplacées par le feu[84].
Plus de 200 espèces différentes composent le régime alimentaire de cet aigle, comme proies vivantes ou comme charognes : l'aigle ravisseur a peut-être le régime alimentaire le plus varié parmi tous les aigles tropicaux[4],[11],[47],[52],[107],[108]. Selon les rapports, la plupart des proies vivantes de l'aigle ravisseur pèsent plus de 125 g et moins de 2,5 kg, cependant des observations révèlent des proies souvent très variées et en-dehors de cette estimation[2],[11],[47],[52]. Une étude compilée a montré qu'en comparaison avec 8 autres espèces des genres Aquila et Clanga, le régime de l'aigle ravisseur est le plus équitablement réparti entre les différentes catégories de poids, avec des proies allant de moins de 63 g à plus de 4 kg ; cependant, pour cette dernière catégorie de poids, l'aigle ravisseur capture un peu moins de proies que l'aigle royal ou l'aigle d'Australie (Aquila audax), mais ces derniers sont bien plus grands. Cette étude a aussi montré que les catégories de poids les plus présentes dans le régime alimentaire de l'aigle ravisseur sont celles de 0,5 kg à 1 kg et de 1 kg à 2 kg, qui à elles deux représentent un peu moins de la moitié de ses proies en quantité[17].
Proies vivantes
_juvenile_eating_a_White-throated_Monitor_Lizard_(Varanus_albigularis)_(16517371167).jpg.webp)
Il est difficile de déterminer si les proies trouvées dans les nids des aigles ravisseurs ont été prises vivantes ou non ; cependant, les observations montrent que pendant l'élevage des jeunes, les parents leur apportent des proies fraîches, qui ont donc probablement été prises vivantes, ou très récemment volées à d'autres prédateurs[11],[52],[107]. Selon une étude au Kenya, seulement 1,9 % des proies apportées au nid étaient susceptibles d'être des charognes[47].
L'aigle ravisseur chasse une grande variété de proies, plus particulièrement des petits ou moyens mammifères, des oiseaux moyens à grands, et plus occasionnellement des reptiles moyens à grands[11],[47],[52]. Une analyse du régime alimentaire au Zimbabwe indique que sur 160 proies, 36,9 % étaient des mammifères, 51,9 % des oiseaux, 10 % des reptiles et 1,2 % des amphibiens[52]. Les espèces les plus représentées étaient la pintade de Numidie (Numida meleagris) qui représentait environ 21 % des proies, et le lièvre des buissons (Lepus saxatilis) à environ 16 % des proies[52]. Une analyse similaire faite dans le parc national de Lochinvar en Zambie a révélé une plus grande proportion d'oiseaux et d'amphibiens (respectivement 61,4 % et 5,5 %), avec un grand nombre d'oiseaux aquatiques parmi les proies, en particulier la foulque à crête (Fulica cristata) et l'anserelle naine (Nettapus auritus)[107]. La différence de régime alimentaire reflète la différence des habitats et de la disponibilité des proies[107]. Une étude détaillée du régime alimentaire des aigles ravisseurs du parc national de Tsavo East au Kenya a été conduite sur plusieurs années. Sur 543 proies étudiées, 41,2 % étaient des mammifères, 35,4 % des oiseaux, et 23,4 % des reptiles et des amphibiens. Les proies les plus représentées étaient le dik-dik de Kirk (Madoqua kirkii) qui représentait 21,7 % du total des proies, le francolin à cou jaune (Pternistis leucoscepus, 6,8 % du total), le lièvre du Cap (Lepus capensi) et le francolin huppé (Dendroperdix sephanea) qui représentaient chacun 6,3 % du total, et l'outarde houppette (Lophotis ruficrista, 5,9 % du total) ; de plus, plusieurs serpents non identifiés représentaient 21,3 % des proies[47].Le dik-dik est une antilope bien plus grande que l'aigle ; ce dernier capture probablement de jeunes dik-diks pesant jusqu'à 4 kg, éventuellement 5 kg. 80 dik-diks sont tués par des aigles ravisseurs dans le parc de Tsavo East chaque année[47]. Dans différentes régions d'Afrique du Sud, de plus petites études du régime alimentaire de l'aigle ravisseur indiquent que les proies apportées au nid sont très variables. Dans le Highveld, 52 % des 60 proies étudiées étaient des mammifères,45 % des oiseaux, et une minorité des poissons. Dans le Timbavati et le Klaserie, 63 % des proies étaient des oiseaux, 34 % des mammifères et 3 % des reptiles. Dans le Highveld, 25 % des proies étaient des mangoustes jaunes (Cynistis penicillata), 15 % des écureuils de terre du Cap (Xerus inauris) et 13 % des pintades de Numidie. Dans le Timbavati et le Klaserie, 44 % des proies appartenaient à diverses espèces de francolins, et 17 % étaient des mangoustes[109],[110].
En-dehors du sud et de l'est de l'Afrique, il y a moins d'études sur le régime alimentaire de l'aigle ravisseur, même au nid. Leurs proies ne sont connues que par des études plus larges, des témoignages secondaires et des photographies[4],[11]. En Éthiopie, il pourrait y avoir une relation étroite entre les populations d'aigles ravisseurs et de rats d'Abyssinie (Arvicanthis abyssinicus), et un aigle a aussi été vu déchirant un nid de corbins de Stresemann (Zavattariornis stresemanni) pour accéder à ses proies[28],[111],[30]. De gros rats non identifiés constituaient une majorité des proies apportées pendant la croissance des petits dans certains nids de l'est de l'Afrique[112]. On connaît encore moins le régime alimentaire de l'aigle ravisseur sur le sous-continent indien[4]. Une étude sans données quantitatives connues indique parmi les proies dans la région de Saurashtra, l'écureuil indien (Funambulus palmarum), les œufs du vanneau indien (Vanellus indicus), des corbeaux, des mangoustes, le lièvre indien (Lepus nigricollis) et même le renard du Bengale (Vulpes bengalensis)[113]. On a aussi observé en Inde des proies extrêmement variées, dont les pattes arrières d'un chaus (Felis chaus), mais qui venaient peut-être d'une carcasse[4]. En général, les aigles ravisseurs de l'Asie du Sud semblent se concentrer sur des proies moins variées, principalement des rongeurs et des lièvres vivant dans les zones désertiques[84],[114],[115].
Ils se nourrissent probablement sur toute leur distribution de plusieurs dizaines d'espèces de rongeurs de différents types, dont la taille varie du rat du Natal (Mastomys natalensis, 30 g) au lièvre sauteur d'Afrique du Sud (Pedetes capensis, 3,6 kg)[114],[115],[116]. Le daman des rochers (Procavia capensis) et le daman de Rhodésie (Heterohyrax brucei) sont parfois chassés par l'aigle ravisseur[117],[118]. L'aigle ravisseur est peut-être le plus grand prédateur des mangoustes : plusieurs études du régime alimentaire les trouvent en nombre relativement important, et l'aigle ravisseur semble être le prédateur le plus craint par les colonies de suricates (Suricata suricatta)[28],[74],[119],[120],[121]. Dans le désert du Karoo, les rapports indiquent que l'aigle ravisseur se nourrit principalement de mangoustes, soit des suricates soit des mangoustes jaunes[122]. Des carnivores de taille similaire ou un peu plus grands, comme la zorille commune (Ictonyx striatus) ou les genettes, font souvent partie des proies de l'aigle ravisseur[11],[109]. Le renard à oreilles de chauve-souris (Otocyon megalotis) peut parfois aussi être chassé[123]. L'aigle ravisseur se nourrit aussi de singes, principalement sous forme de charognes, mais il peut parfois chasser les juvéniles du patas (Erythrocebus patas), du grivet (Chlorocebus aethiops) ou du vervet (Chlorocebus pygerythrus), et même les juvéniles de certaines espèces de babouins[47],[117],[124],[125],[126]. Cependant, contrairement à l'aigle de Verreaux, l'aigle ravisseur ne déclenche pas de réaction chez les babouins hamadryas montrant qu'il serait perçu comme une menace[127]. Alors que certains ongulés comme les dik-diks viennent probablement de charognes ou de cleptoparasitisme d'autres prédateurs, les petits d'autres ongulés comme la gazelle de Thomson (Eudorcas thomsonii) sont parfois tués par l'aigle ravisseur[128]. Plus généralement, il semble que l'aigle ravisseur capture des mammifères relativement grands, et souvent pesant entre 3 kg et 4 kg comme les lièvres, les dik-diks et les petits d'autres antilopes, les damans, etc[11],[20],[52],[129].

Plus encore que pour les mammifères, la diversité des espèces d'oiseaux chassés par l'aigle ravisseur est remarquable, on compte plus de 120 espèces d'oiseaux dans son régime alimentaire[4],[11],[47],[107],[109]. Parmi ces espèces se trouvent plusieurs espèces de canards, de petites oies[47],[109],[130], ainsi que des galliformes, principalement des francolins et des pintades[4],[46],[47],[52], de nombreux pigeons[11],[35],[131], des outardes et des calaos[46],[47],[35],[109],[132],[133], et de nombreux oiseaux aquatiques, allant des courvites, vanneaux, rallidés et grèbe castagneux, à de plus grands oiseaux comme les flamants, cigognes et hérons[11],[47],[109]. L'aigle ravisseur peut attaquer des jeunes et des adultes des deux espèces de flamants d'Afrique, mais aussi des cormorans à poitrine blanche (Phalacrocorax lucidus) et des grands cormorans (Phalacrocorax carbo), des oiseaux qui ont la même taille, voire sont un peu plus grands, que l'aigle lui-même[134],[135],[136]. Il choisit parfois même des proies encore plus grandes, comme une grue cendrée (Grus grus) tuée par un couple dans le Saurashtra (mais elle était déjà blessée) et une outarde kori (Ardeotis kori) probablement adulte. Si leur taille était dans la moyenne, ces oiseaux pesaient sûrement plus de 5 kg[113],[40],[137]. Plus occasionnellement, l'aigle ravisseur peut chasser d'autres oiseaux comme les engoulevents, les coucals, les pterocliformes, le martinet batassia, les guêpiers, les martins-pêcheurs, les rolliers, les irrisors, les touracos, les perroquets, et plusieurs passereaux[4],[11],[35],[47],[109],[138],[139],[140],[141] L'un des passereaux le plus souvent chassés par l'aigle ravisseur est l'abondant travailleur à bec rouge (Quelea quelea)[142]. Près des fermes d'élevage, l'aigle ravisseur capture souvent des poulets (Gallus gallus domesticus) et d'autres volailles laissées à l'extérieur, en particulier quand il doit nourrir ses petits, ce qui lui attire la colère des éleveurs[4],[11],[37],[143].
L'aigle ravisseur peut parfois chasser divers serpents, et il n'hésite pas à attaquer des serpents venimeux[144]. Dans le sud de l'Afrique et au Kenya, plusieurs serpents ont été identifiés dans son régime alimentaire : le boa des sables du Kenya (Eryx colubrinus), le python de Seba (Python sebae), les serpents du genre Psammophis, le Rhamphiophis oxyrhynchus, le cobra cracheur à cou noir (Naja nigricollis), le mamba noir (Dendroaspis polylepis), le boomslang (Dispholidus typus) et la vipère heurtante (Bitis arietans)[11],[47],[145]. Il peut aussi chasser des lézards quand il en a l'occasion, souvent des espèces assez grandes, mais qui peuvent aller du gecko léopard (Eublepharis fuscus) au varan des steppes d'Afrique orientale[11],[35]. Dans un nid au Zimbabwe, les varans constituaient 29 % des 83 proies trouvées, mais ils ne représentaient que 8 % des 107 proies trouvées dans trois nids différents du même parc[52]. L'une des proies les plus fréquentes de l'aigle ravisseur en Inde semble être Saara hardwickii[4],[146],[147]. De manière plus anecdotique, l'aigle ravisseur peut aussi se nourrir de tortues, de grenouilles, de crapauds et de poissons. Un aigle ravisseur a été observé en Afrique du Sud pêchant en eaux peu profondes un poisson-chat assez grand[11],[107],[109],[148]. Il se nourrit aussi d'insectes communautaires, généralement des termites, qui peuvent nourrir des aigles non reproducteurs ou des jeunes. Quand il visite les termitières, un aigle ravisseur peut se nourrir des termites ailés, et, sans agression, partager la nourriture avec d'autres oiseaux de proie, parfois avec une demi-douzaine d'oiseaux de la même espèce[149],[150]. L'aigle ravisseur est parfois aussi attiré par les nuages de sauterelles[151]. Un aigle ravisseur a été observé consommant les fruits d'un baobab, un cas rare de comportement frugivore qu'on ne retrouve couramment que chez une autre espèce de rapace, le palmiste africain (Gypohierax angolensis)[11]. Un aigle ravisseur a aussi été observé fouillant des déjections d'éléphant avec un vautour à tête blanche, probablement à la recherche de bousiers[152].
Charognes
_and_White-backed_Vultures_(Gyps_africanus)_(6001455023).jpg.webp)
Même si l'aigle ravisseur chasse, il se nourrit aussi beaucoup de charognes[11]. La plupart des aigles du genre Aquila consomment occasionnellement des charognes, mais aucun ne le fait aussi souvent[11],[45]. L'aigle ravisseur a été observé se nourrissant d'une grande variété de carcasses, allant de l'éléphant de savane d'Afrique (Loxodonta africana) au vervet, et peut-être même aussi petites que des colombes[11],[153]. En Afrique en particulier, l'aigle ravisseur se nourrit beaucoup de cadavres d'ongulés comme les antilopes[11],[52] : au moins 30 ou 40 espèces d'ongulés sont répertoriées comme consommées par les aigles ravisseurs sous forme de charognes[4],[11],[47],[52]. En Éthiopie, des « restaurants de vautours » ont été aménagés avec du bétail mort pour nourrir les vautours d'Afrique et empêcher leur déclin ; l'aigle ravisseur est le second charognard le plus observé à ces endroits, il représentait 35 % des 1088 oiseaux observés en train de se nourrir là-bas[154]. L'aigle ravisseur partage presque systématiquement les charognes avec des vautours, mais aussi avec des chacals et des hyènes, ainsi qu'avec d'autres oiseaux comme le bateleur des savanes, plusieurs aigles (notamment l'aigle des steppes) ou le marabout d'Afrique (Leptoptilos crumenifer)[11],[155],[156]. Il est possible que les vautours comptent sur les aigles pour repérer les carcasses[157]. Grâce à leur plus petite taille, l'aigle ravisseur et le bateleur peuvent s'envoler plus tôt le matin, et ont donc plus de chances de repérer les carcasses les premiers[157]. Sur 91 carcasses observées en Afrique du Sud, il est établi que les aigles ravisseurs étaient les premiers à en trouver 5. Dans 75 % des cas, les vautours arrivaient en moins de 40 minutes après la découverte de la carcasse par l'aigle ravisseur[158]. Sur les grandes carcasses, une hiérarchie s'établit sur la base de la taille des charognards[155]. Dans la réserve nationale du Masai Mara, le haut de la hiérarchie est occupé par les grands mammifères comme la hyène tachetée (Crocuta crocuta), le chacal à chabraque (Canis mesomelas) et les chiens errants (Canis lupus familiaris), puis le vautour oricou (Torgos tracheliotos) et le vautour de Rüppell (Gyps rueppelli), suivi par les autres vautours, l'aigle ravisseur et le bateleur des savanes arrivant à la fin de la hiérarchie[159]. Des hiérarchies similaires entre charognards ont également été observées à d'autres endroits[155],[156]. Dans la réserve du Masai Mara, le bateleur des savanes était le charognard avec la meilleure probabilité de repérer une carcasse, et lui et l'aigle ravisseur sont considérés comme des charognards à « faible potentiel de compétition et haute efficacité de recherche »[159].
L'aigle ravisseur est capable de repousser de petites espèces de vautours, comme le vautour charognard (Necrosyrtes monachus) et le percnoptère (Neophron percnopterus), qui ont à peu près la même taille que lui ; un aigle a même été observé tenant 20 vautours à l'écart d'une carcasse. Cependant, d'après les rapports disponibles, un tel comportement agressif sur une grande carcasse est sûrement inhabituel de la part de l'aigle ravisseur[11],[52],[159],[160]. L'aigle ravisseur a cependant tendance à dominer le bateleur des savanes sur les carcasses[11]. Les vautours fauves et les autres vautours du genre Gyps sont généralement les plus nombreux sur les carcasses, et ils sont plus grands que l'aigle ravisseur, mais peuvent tolérer temporairement qu'il se nourrisse en même temps qu'eux, selon les circonstances[11],[161],[153]. Généralement, plus les vautours fauves sont nombreux, moins l'aigle ravisseur a de chances de manger[45],[159],[161],[153]. L'aigle préfère souvent rester à l'écart de la frénésie alimentaire des vautours, et attend que des morceaux de chair soient projetés vers lui. Il est souvent capable de récupérer de petits morceaux, mais attend que la carcasse soit terminée et qu'il ne reste plus que quelques vautours. Amener d'autres charognards aux cadavres et se nourrir après eux peut être bénéfique à l'aigle ravisseur dans le sens où, contrairement aux grands vautours comme le vautour oricou ou le vautour moine (Aegypius monachus), il ne peut pas ouvrir les grandes carcasses seul, et a besoin qu'un autre charognard le fasse pour qu'il accède aux viscères[4],[11],[45],[52],[155],[161]. S'il tombe sur une carcasse non ouverte, l'aigle ravisseur a peu d'options pour se nourrir, mais peut parfois manger les yeux : un aigle ravisseur a été observé en train de le faire sur un cheval mort laissé par des chercheurs à son intention[158]. La mortalité animale due aux véhicules fournit aussi de la nourriture aux aigles ravisseurs : les corps étant souvent déjà ouverts par l'impact avec les véhicules, l'aigle ravisseur peut monopoliser au moins temporairement la carcasse[4],[11],[27]. Dans la réserve du Masai Mara, les aigles ravisseurs profitent de carcasses situées plus près des habitations humaines et dans un environnement moins riche que les autres charognards[159]. En Inde, l'aigle ravisseur est présent dans des décharges, où les vautours vont rarement, mais où les aigles ravisseurs en hivernage se rendent régulièrement pour se nourrir[4],[35]. Il visite aussi régulièrement les décharges en Afrique, en particulier en Ouganda et en Éthiopie[162],[163]. Les vautours prédateurs et agressifs, comme les vautours à tête blanche (Trigonoceps occipitalis) en Afrique ou les vautours royaux (Sarcogyps calvus) en Inde, ainsi que les vautours oricous et les vautours moines, ont tendance à ne pas tolérer la présence des aigles ravisseurs et à les empêcher d'approcher des carcasses jusqu'à ce que les vautours eux-mêmes soient rassasiés[4],[11],[52],[164]. Cependant, des vautours à tête blanche et des aigles ravisseurs ont parfois été observés en train de partager paisiblement des corps d'animaux victimes du trafic routier[11]. L'aigle ravisseur, ainsi que d'autres petits charognards comme le bateleur des savanes, les petits vautours et les corbeaux, préfère souvent les carcasses de petits animaux, probablement pour éviter la concurrence entre charognards qui a lieu autour des carcasses plus grandes[4],[45],[155],[158],[159]. Un aigle ravisseur a été observé en train de suivre une meute de lycaons (Lycaon pictus), probablement pour se nourrir des corps de leurs proies[165].
Cleptoparasitisme
_and_Young_Bateleur_(Terathopius_ecaudatus)_(6017682851).jpg.webp)
Comme son nom l'indique, l'aigle ravisseur utilise aussi les proies volées à d'autres espèces en plus de ses propres proies et des charognes[6],[11]. En afrikaans, il porte le nom de roofarend ou « aigle voleur »[6]. Ce comportement ressemble un peu à celui qu'il a lorsqu'il partage des carcasses, mais il fait preuve de beaucoup d'audace et d'agressivité dans les cas de cleptoparasitisme comparé à son comportement plutôt effacé sur les charognes[11],[52],[166]. L'aigle ravisseur est parfois même décrit comme « sans peur » dans ses attaques de piraterie d'autres prédateurs, auxquelles il a probablement recours plus souvent que n'importe quel autre oiseau de proie[5],[11]. D'autres rapaces comme l'aigle des steppes ou l'aigle impérial, ainsi que les pygargues, peuvent avoir ponctuellement et localement recours au cleptoparasitisme, mais l'aigle ravisseur le pratique régulièrement partout sur son aire de répartition[4],[11],[46]. Seuls quelques oiseaux marins, comme les labbes ou les frégates, sont aussi susceptibles de tirer la majeure partie de leur nourriture d'actes de cleptoparasitisme[167],[168]. Généralement, l'aigle ravisseur surprend les autres rapaces en arrivant brutalement, et attrape la proie en quelques secondes ; si la proie tombe à terre, il évite autant que possible d'atterrir complètement, pour pouvoir repartir avec le plus vite possible[11],[52],[145]. La taille des oiseaux volés par l'aigle ravisseur varie, il peut s'agir d'espèces aussi petites que l'élanion blanc (Elanus caeruleus) ou le faucon crécerelle (Falco tinnunculus), mais aussi de rapaces plus grands comme le gypaète barbu (Gypaetus barbatus)[5]. Il semble que l'aigle ravisseur ne pose guère de limites aux espèces qu'il vole, tant qu'il a l'occasion de le faire[11],[46]. On a observé un couple d'aigles ravisseurs attaquer un messager sagittaire (Sagittarius serpentarius) qui venait de tuer une grande vipère heurtante, et réussir à écarter le sagittaire et un gymnogène d'Afrique (Polyboroides typus) qui tentait aussi de s'en emparer, avant de partager la vipère entre les deux aigles[112]. L'aigle ravisseur s'attaque aussi régulièrement aux proies d'autres rapaces comme l'autour sombre (Melierax metabates), le bateleur des savanes, le faucon lanier (Falco biarmicus), et même des rapaces aussi gros que l'aigle martial (Polemaetus bellicosus) ou l'aigle de Verreaux (Aquila verreauxii) ; ces derniers, étonnamment, se défendent très peu des attaques de cleptoparasitisme de l'aigle ravisseur, alors qu'ils sont beaucoup plus forts et dotés de serres puissantes[11],[52],[169],[170]. D'autres oiseaux carnivores qui ne sont pas considérés comme des rapaces, comme le marabout d'Afrique ou la bucorve du Sud (Bucorvus leadbeateri), peuvent aussi être parfois victimes du cleptoparasitisme de l'aigle ravisseur[11],[171],[172]. Des vols peuvent aussi avoir lieu entre l'aigle ravisseur et le bateleur des savanes, une espèce d'une taille et d'une force similaires à celles de l'aigle ravisseur. 5 bateleurs ont été observés en train d'écarter des aigles ravisseurs de leurs proies, mais 26 aigles faisant de même pour les bateleurs, soit bien plus[173]. Des rapaces plus petits ont été victimes de ce cleptoparasitisme, notamment lors de l'attaque d'une colonie de travailleurs à bec rouge ; certains d'entre eux avaient été attaqués mais pas tués par des faucons laniers, d'autres ont été disputés à des chacals[11],[52].
Parfois, l'aigle ravisseur est lui-même victime de cleptoparasitisme. Des aigles plus grands ont été observés écartant des aigles ravisseurs de leurs proies, comme le pygargue vocifer (Haliaeetus vocifer), l'aigle impérial et l'aigle des steppes[4],[11],[174],[175]. En Inde, le pygargue vocifer et le pygargue de Pallas (Haliaeetus leucoryphus) semblent tous les deux dominer l'aigle ravisseur sur certaines sources de nourriture partagées, comme les carcasses ou les zones de nidification des oiseaux aquatiques[5],[4]. Dans le massif du Balé en Éthiopie, l'aigle royal peut écarter et dominer l'aigle ravisseur qui est bien plus petit que lui[176]. Plus rarement, le bateleur des savanes peut réussir à voler l'aigle ravisseur[173]. Certains vautours comme le vautour oricou peuvent s'approprier les proies des aigles ravisseurs, et écarter ces derniers ; il est aussi probable, sans confirmation, que les chacals volent leurs proies, comme ils le font avec d'autres aigles. Les grosses proies, dont certaines pèsent deux fois plus lourd que l'aigle, sont trop lourdes pour la charge alaire de l'aigle ravisseur, et doivent souvent être abandonnées aux autres carnivores[155],[159],[145]. En Éthiopie, des loups d'Abyssinie ont été observés volant à des aigles ravisseurs des rongeurs fraîchement tués ; ils ont réussi 5 fois sur 21 tentatives[177]. Même des oiseaux plus petits comme le corbeau familier (Corvus splendens) ont pu être observés en train de voler la proie d'un aigle ravisseur[178].
Prédation inter-espèces

La répartition de l'aigle ravisseur en Afrique et en Inde le place dans deux des environnements les plus concurrentiels pour les rapaces au monde[4],[11]. Il s'y est probablement adapté par son absence de spécialisation dans un type de proie particulier, dans un style de chasse ou dans une source de nourriture, et en incluant un important comportement de charognard dans son alimentation[11],[52]. Son habitat se superpose à celui de beaucoup d'aigles et d'autres rapaces[6],[11] ; cependant, les aigles hivernants ou sédentaires des genres Aquila et Clanga occupent généralement des habitats un peu différents de celui de l'aigle ravisseur[2],[4],[47]. Dans le parc national de Tsavo East, l'écologie de l'aigle ravisseur a été largement étudiée en comparaison de celle du bateleur des savanes et de l'aigle martial, qui semblent avoir des habitats et des choix de proies similaires, ainsi que du plus petit aigle fascié qui tend à habiter plutôt les forêts sèches[47]. Cette étude a montré que les quatre espèces ont pour proie principale le dik-dik de Kirk, mais que l'aigle martial et l'aigle fascié chassent des dik-diks plus grands que le bateleur et l'aigle ravisseur, qu'ils en attrapent plus par couple, et qu'ils ont moins tendance à voler des proies[47]. Le régime alimentaire de l'aigle ravisseur recoupe celui du bateleur des savanes dans le parc de Tsavo East à 64 %, mais ne recoupe celui de l'aigle martial qu'à 29 %. L'aigle ravisseur est aussi le seul à ajouter de nombreuses proies alternatives, comme des serpents, à son régime alimentaire, bien que le bateleur ait aussi une grande diversité dans ses proies[47]. L'étude de Tsavo East indique aussi que la pression des prédateurs sur les dik-diks est modérée temporairement par le léger décalage des saisons de nidification des différents aigles : le bateleur fait son nid un peu plus tôt, l'aigle fascié un peu plus tard, si bien que les pics de prédation ne se chevauchent généralement pas[47]. D'autres études indiquent qu'en Afrique, le bateleur des savanes est très proche de l'aigle ravisseur dans la plupart des aspects de son écologie[179]. Les habitudes de nidification de l'aigle ravisseur le distinguent de la plupart des autres aigles : il fait son nid presque exclusivement à la cime des arbres, plutôt que dans le tronc ou sur une grande branche (ou les flancs de falaises, ou même le sol comme pour l'aigle des steppes)[11],[180]. La nidification de l'aigle ravisseur ressemble davantage à celle des vautours[155]. Une étude menée dans le parc national Kruger indique que l'aigle ravisseur et le vautour africain (Gyps africanus) utilisent souvent des nids à la cime des arbres construits par d'autres espèces[153]. À l'inverse, d'autres oiseaux comme des grands hiboux ou des serpentaires peuvent utiliser d'anciens nids d'aigles ravisseurs[11]. Bien que les habitats de l'aigle ravisseur et de l'aigle martial soient largement similaires, une étude détaillée dans le désert du Karoo indique que l'aigle ravisseur préfère des habitats avec des pluies plus abondantes et plus prédictibles en été, et donc une plus grande production primaire[181].
L'aigle ravisseur peut parfois chasser d'autres rapaces plus petits, mais c'est rare, et il y a peu d'observations de captures de rapaces par cet aigle. Un mâle affamé ou à la recherche de nourriture peut parfois piller les nids d'autres rapaces[47],[112]. Les oiseaux imprudents, distraits ou blessés sont les plus susceptibles d'être tués par l'aigle ravisseur[52],[182]. Parmi les oiseaux diurnes auxquels il s'attaque en Afrique, on trouve l'élanion blanc, le vautour charognard, l'autour chanteur (Melierax canorus) et le fauconnet d'Afrique (Polihierax semitorquatus)[47],[46],[109],[182]. En Inde, l'aigle ravisseur peut s'attaquer au busard des roseaux (Circus aeruginosus), à l'épervier shikra (Accipiter badius) et au busautour aux yeux blancs (Bustastur teesa)[35],[113]. Les rapaces nocturnes sont également vulnérables aux attaques d'aigles ravisseurs ; parmi eux, la chouette effraie (Tyto alba), le grand-duc africain (Bubo africanus), la chevêche d'Athéna (Athene noctua), la chevêchette perlée (Glaucidium perlatum) et le hibou du Cap (Asio capensis)[47],[182],[183]. Les restes d'un messager sagittaire ont été retrouvés dans le nid d'un aigle ravisseur, mais sans pouvoir confirmer si l'aigle l'a tué ou a simplement récupéré son cadavre[11]. Bien que l'aigle ravisseur soit de taille moyenne, il ne semble pas être la proie d'autres prédateurs à l'âge adulte, et remplit donc les caractéristiques d'un superprédateur[11],[46],[107]. Les nids et les aiglons sont vulnérables à certains prédateurs. Parmi ces derniers, on trouve probablement des corvidés, des serpents et d'autres carnivores capables d'escalader les arbres[2],[52],[107]. Il a été confirmé que le ratel (Mellivora capensis) s'attaque aux aiglons au nid[184].
Reproduction
Formation des couples et territoires
L'aigle ravisseur semble former des couples pour la vie. Comme la plupart des oiseaux de proies, ils défendent leur territoire contre les autres membres de leur espèce[2],[11]. Ils volent souvent seuls ou en couple en formant des cercles en hauteur ou en s'élevant en spirale. Le mâle peut parfois plonger et remonter à plusieurs reprises autour de la femelle, même si elle n'y répond généralement pas[2]. Les couples peuvent s'engager dans des ballets aériens pour renforcer leurs liens[4]. De temps en temps, on peut voir des aigles ravisseurs entrelacer leurs serres et plonger rapidement, pouvant descendre de 30 m en quelques secondes, en se décrochant parfois juste avant d'atteindre le sol[4]. Chez d'autres espèces de la sous-famille des Aquilinae, ce type d'interaction est généralement considéré comme un combat entre un aigle sur son territoire et un intrus du même sexe. On a d'abord considéré que c'était aussi le cas de l'aigle ravisseur, en estimant que 82 % de ces interactions étaient des comportements agressifs, 11 % des parades amoureuses et 7 % du simple jeu. Cependant, d'autres observations plus poussées ont mis en évidence que ces interactions entre mâles et femelles sont un élément récurrent de la parade amoureuse[185],[186],[187]. Les mâles effectuent aussi des ballets aériens où ils descendent et remontent avec les ailes partiellement refermées, en poussant des cris ; cependant ce comportement particulier semble rare[2]. Deux mâles ont été observés effectuant une parade destinée à la même femelle[113]. Selon un spécialiste, la parade amoureuse de l'aigle ravisseur n'est « pas particulièrement spectaculaire comparée aux autres aigles »[11].
La saison de reproduction se déroule entre mai et août au nord-est de l'Afrique, d'octobre à juin en Afrique de l'Ouest, et presque toute l'année dans le centre, l'est et le sud de l'Afrique ; cependant, l'aigle ravisseur se reproduit principalement entre mai et novembre au Kenya, et entre avril et janvier dans le centre et le sud de l'Afrique[2],[188]. En Inde, la saison de reproduction se déroule entre novembre et mai, mais peut varier jusqu'à octobre et août[2],[4]. La reproduction a lieu dans le nid ou à proximité[4].
La densité de population est très variable sur le continent africain, et chaque couple occupe entre 75 km2 et 300 km2[2]. L'espace entre deux nids au Zimbabwe est compris entre 7 km et 10 km selon une étude. Au bord du parc national Kruger, 7 couples ont été observés sur un espace de 460 km2 au total, mais sur des pylônes régulièrement espacés dans le Transvaal, les nids étaient espacés de 19 km à 20 km[11]. Dans le parc national Hwange, sur 11 ans d'étude, 92 couples ont été observés nichant sur le basalte sur une zone de 4 724 km2, et 84 couples sur le sable du désert du Kalahari sur 9 876 km2. La distance moyenne entre deux nids sur le basalte était de 4 km et de 59 km sur le sable[3]. En Zambie, la densité est d'un couple pour 28 km2, ce qui est considéré comme élevé pour cette espèce[107].
Nid
Le nid de l'aigle ravisseur est une large plate-forme faite de branches, mais qui peut aussi contenir des os d'animaux[2]. Les sites de nidifications sont souvent situés sur des zones plates ou de collines, ouvertes, offrant une bonne vue dominante sur les environs. Ils sont souvent proches de trous d'eau, et, plus généralement en Inde, proches de villages[2],[4],[11]. Le nid se situe entre 6 m et 15 m au-dessus du sol, mais peut aller jusqu'à 30 m[2]. Il est placé à la cime des arbres, beaucoup plus rarement sur une branche latérale[2],[11]. Au Kenya, l'aigle ravisseur ne montre pas de préférence particulière sur la hauteur ou la répartition des arbres, mais il préfère les euphorbes et les genres Boscia et Euclea[159]. Dans le nord de l'Inde, les arbres qu'il choisit pour nicher sont le figuier des pagodes, le sesham et le manguier ; dans le district de Kutch et le Rajasthan, il niche dans le gommier rouge, où les nids sont situés entre 4 m et 6 m de haut, mais plus souvent 4 m[4],[189]. Les arbres épineux sont appréciés car ils apportent une protection supplémentaire[11]. Malgré leur position dominante en haut des arbres, les nids peuvent être difficiles à repérer depuis le sol[11],[188]. Dans le parc transfrontalier de Kgalagadi en Afrique du Sud, l'aigle ravisseur fait son nid au sommet du grand Vachellia erioloba, souvent les arbres les plus grands et les plus larges, avec une hauteur moyenne de 10,9 m[93]. En Inde, l'aigle ravisseur réutilise le même nid pendant plusieurs années, mais l'espèce est menacée par l'abattage des arbres[4]. Dans le parc de Kgalagadi, il reconstruit un nouveau nid chaque année, et seulement 2 % des nids sont réutilisés pour la reproduction[93]. La réutilisation des nids en Afrique est probablement limitée par les risques d'effondrement et la pousse rapide de nouvelles branches autour du nid. Quand un nouveau nid est construit, c'est généralement à moins de 2 km du précédent[11]. Mâles et femelles participent à la construction du nid, et la réparation d'un nid peut prendre 4 à 7 semaines, bien que le gros de la construction puisse être terminé en une semaine[11]. Le nid de l'aigle ravisseur est relativement large et plat comparé aux autres espèces d'aigles[11]. Il mesure environ 1 m de diamètre pour 20 cm de profondeur, mais peut atteindre 1,3 m de diamètre et 30 cm de profondeur en étant réutilisé et reconstruit[2],[52]. Le nid est souvent décoré d'herbes, de feuilles et de graines, mais parfois aussi d'objets insolites comme des journaux, du papier d'emballage ou des sacs plastiques[2],[11]. Dans le parc national Kruger, l'aigle ravisseur peut réutiliser des nids d'autres rapaces comme le vautour africain ou le vautour à tête blanche[52]. Des nids d'aigles ravisseurs ont été observés au sommet de nids collectifs d'alecto à tête blanche (Dinemellia dinemelli)[11]. Dans le désert du Karoo, l'aigle ravisseur peut faire son nid sur les pylônes électriques[190]. D'autres espèces comme l'aigle martial ou l'aigle de Verreaux nichent aussi sur ces pylônes, au moins depuis les années 1970[190]. Entre 2002 et 2003, 39 % des problèmes électriques constatés sur les lignes étaient dus à la présence de nids d'aigles. Les nids qui posaient problème ont été démolis et reconstruits sous les lignes électriques[190].
Œufs


Les œufs sont pondus à quelques jours d'intervalle, le plus souvent pendant la saison sèche mais parfois aussi pendant la saison humide[2]. Dans le désert du Kalahari, des études ont prouvé que le moment de la ponte est lié à la possibilité d'exploiter des sources de nourritures par temps plus clément au moment où il y aura des petits au nid. La présence de petits mammifères et la période de mise bas des springboks (Antidorcas marsupialis) est particulièrement favorable[191]. En Inde, les intervalles de ponte sont plus longs si l'habitat est moins optimal[4]. Sur 26 nids d'aigles ravisseurs observés entre 1988 et 1996 dans le parc transfrontalier de Kgalagadi, 84,6 % des pontes ont eu lieu entre mars et juin[93]. On retrouve des dates similaires en Zambie, au Zimbabwe[107],[11] et dans la réserve nationale du Masai Mara au Kenya, ainsi que dans d'autres régions du sud et du sud-est de l'Afrique[56],[192],[193]. Des pontes ont été observées en juillet et en août, mais il pourrait s'agir de pontes de remplacement[11]. Les données des pontes au nord et à l'ouest de l'Afrique indique que les aigles ravisseurs y pondent plus tôt, généralement de janvier à avril. Au Ghana, elles ont lieu d'octobre à février, mais principalement en décembre et en janvier ; en Éthiopie, de novembre à février ; au Maroc, autour du mois d'avril[28],[65],[58],[194],[195],[196]. Les dates de ponte varient également en Inde : dans le Penjab, l'Uttar Pradesh et le Bihar, elle a lieu principalement en janvier, tandis que dans le district de Kutch et Jaisalmer, les aiglons quittent déjà les nids à cette période[4].
L'aigle ravisseur peut pondre de 1 à 3 œufs, avec une moyenne de 1,7 œuf par ponte[11],[107]. Dans le parc national Hwange on a observé qu'il y a moins d'œufs par ponte pendant les années plus sèches[3]. Les œufs sont blancs, faiblement tachetés de brun, avec des variations : les œufs peuvent être presque unis, ou au contraire très marqués de diverses taches de brun rougeâtre[5]. Sur 67 œufs de la sous-espèce principale, la hauteur variait entre 64 mm et 75,7 mm et le diamètre entre 49,9 mm et 60 mm, avec une moyenne de 69,6 mm de hauteur et 54,8 mm de diamètre. Un autre échantillon de 30 œufs de la même sous-espèce avait une moyenne de 71,5 mm de hauteur et 56,3 mm de diamètre. Pour la sous-espèce A. r. vindhiana, 80 œufs ont été mesurés entre 58 mm et 75,2 mm de hauteur et entre 46,4 mm et 57,6 mm de diamètre, avec une moyenne de 66 mm de hauteur et 52,8 mm de diamètre[5],[11].
Développement des jeunes et comportement des parents
Les œufs sont couvés par la femelle entre 40 et 44 jours, avec des extrêmes de 35 à 45 jours, avant l'éclosion[2]. L'incubation commence avec le premier œuf, et est faite exclusivement par la femelle en Inde, mais en Afrique, le mâle peut prendre brièvement la relève[2],[4]. Si on approche du nid, la femelle reste en place le plus longtemps possible et ne s'envole qu'à la dernière minute[4]. Elle peut continuer de décorer le nid avec de la verdure pendant la couvaison[11]. À l'éclosion, les petits doivent être constamment protégés du soleil, le nid étant très exposé[2],[5]. Ils naissent avec un peu de duvet blanc, un bec noir, des cires et des pieds jaunes, et des yeux marron ; un duvet blanc plus épais apparaît à 2 semaines, et une semaine plus tard, les premières plumes poussent sur les scapulaires et les couvertures des ailes[11]. Les aiglons peuvent commencer à se tenir debout à 3 semaines, marcher dans le nid à 4 semaines, et commencent à remuer leurs ailes environ une semaine après[11],[52]. Les plumes des ailes et de la queue poussent rapidement, et celles du côté de la poitrine apparaissent à 4 semaines. Vers 5 semaines, les aiglons sont presque recouverts de plumes, sauf au niveau de la tête et du dessous. À sa septième semaine, l'aiglon n'a plus que quelques restes de duvet, et pèse environ 2,15 kg[11],[52]. Le développement rapide des plumes du dos est comparable à celui d'autres espèces de rapaces dont les nids sont exposés, comme le messager sagittaire ou les serpentaires[11].
Généralement, un seul aiglon survit[11],[46], ce qui est souvent dû au caïnisme, où le premier aiglon attaque mortellement le second âgé de quelques jours. Le premier aiglon pèse généralement 143 g à ce stade alors que le plus jeune ne pèse que 85 g au moment de sa disparition[11]. Dans le sud de l'Afrique, on a cependant observé au moins quatre cas de nids contenant deux jeunes aigles vivants[11],[197]. À 5 semaines environ, l'aiglon adopte un comportement anti-prédateurs, certains s'allongeant à l'approche d'un nouvel animal pour se cacher, d'autres adoptant au contraire une posture menaçante avec les plumes hérissées, le bec ouvert, les ailes relevées et les serres prêtes à griffer[11]. Pendant les dix premiers jours, la femelle surveille son petit de près et compte sur le mâle pour lui apporter sa nourriture. Après deux semaines, elle laisse le petit seul pendant environ deux heures et demi par jour pendant qu'elle va chercher de la nourriture. À ce moment, le mâle peut aussi venir nourrir le petit. Pour un aigle de sa taille, l'aigle ravisseur commence à quitter son nid relativement tôt, et le nid peut être sali par des restes[11],[52]. On a observé un aiglon âgé de 39 jours qui était capable de déchiqueter ses aliments lui-même, mais était toujours principalement nourri par sa mère[11]. La première tentative de vol a lieu entre 7 et 10 semaines, et l'aiglon est complètement développé et capable de quitter le nid entre 10 et 12 semaines[2],[52]. Cependant, la mère reste au nid, en particulier si elle doit s'abriter des orages, jusqu'au moment de l'envol[2]. Le jeune aigle reste dépendant environ 6 semaines après son envol, et reste même parfois avec ses parents jusqu'à la saison de reproduction suivante[2]. En Inde, quand la nidification est terminée, les couples se dispersent et quittent les zones de nidifications, et y reviennent rarement avant la nouvelle saison de reproduction en octobre[4]. Un juvénile abattu à l'âge de deux ans se trouvait à 48 km de son nid d'origine ; deux autres juvéniles, l'un de cinq mois et l'un de sept mois, se trouvaient respectivement à 50 km et 34 km de leurs nids d'origine[11].
Succès de reproduction et causes des échecs

Les pertes d'œufs et de jeunes au nid sont élevées[2]. Les jeunes aiglons sont souvent victimes de leurs aînés, ou de nombreux prédateurs si le nid n'est pas bien gardé[2]. Le succès de la reproduction est lié à la qualité de l'habitat et à la présence de nourriture[4]. Des efforts de reproduction au Zimbabwe ont permis d'obtenir 19 jeunes pour 26 couples, avec un taux de remplacement de 0,73 petit par couple et par an[52]. En Inde, l'aigle ravisseur s'adapte à la difficulté de son environnement sablonneux en dispersant ses nids, et obtient un taux similaire de petits par nids[4]. Dans le parc national Hwange, 72,4 % des couples se reproduisent en moyenne par an, et produisent environ 0,61 petit par couple[198]. Ces études montrent que la clé d'une bonne reproduction de l'aigle ravisseur est la présence de pluie : les pontes de deux œufs sont plus fréquentes que les pontes d'un seul œuf (qui n'arrive généralement pas à terme) et les périodes de reproduction sont plus larges pendant les années de pluies importantes[52],[198]. Le succès de reproduction, mesuré en nombre de petits par couple et par an, est plus faible en Namibie et dans le parc national de Tsavo East qu'au Zimbabwe (0,4, 0,5 et 0,78 petit par couple et par an, respectivement)[52],[107]. La reproduction est meilleure en Zambie avec une moyenne d'un petit par couple et par an[107]. Bien qu'il n'y ait pas d'étude complète sur la longévité de l'aigle ravisseur, on pense qu'il peut vivre au moins 16 ans dans la nature[6],[199].
Statut
Conservation
L'aigle ravisseur occupe toujours un vaste territoire[7]. En Afrique on estime que ce territoire représente 15 millions de km², plus 3,1 millions de km² en Asie[2]. Dans les années 1990, la population mondiale d'aigles ravisseurs était estimée à six chiffres, la population asiatique représentant à elle seule plusieurs centaines de milliers d'individus[2]. Cependant, l'aigle ravisseur est classé espèce vulnérable sur la liste des espèces menacées de l'UICN[7]. En effet, la population actuelle représente moins de la moitié de ce qu'on estimait précédemment : elle est estimée entre 100 000 et 500 000 pour le monde entier[7]. Il y a eu une forte baisse des observations d'aigles ravisseurs dans le sud de l'Afrique entre les projets de recensement SABAP (1987-1991) et SABAP2 (depuis 2007), avec seulement 323 observations dans 1 440 zones d'observation[200]. Les populations d'aigles ravisseurs et d'aigles martiaux ont été soigneusement étudiées dans le centre de la Namibie et un fort déclin des deux a été mis en évidence : pour l'aigle ravisseur, on ne comptait plus que 2 couples contre 19 précédemment[201]. Les aigles ravisseurs, autrefois nombreux dans le parc transfrontalier de Kgalagadi, n'étaient déjà plus que 40 couples dans les années 1990[202]. Des comptages sur le bord des routes au Mali, au Niger et au Burkina Faso ont indiqué que la majorité des espèces de rapaces est en déclin rapide, mais que les aigles ravisseurs et les serpentaires sont les seuls à encore survivre en-dehors des zones protégées[203]. En Inde, l'aigle ravisseur était autrefois considéré comme l'aigle « le plus commun »[37], mais de forts déclins ont aussi été observés, les études indiquant que le nombre de couples a diminué de moitié dans des endroits comme le Rajasthan[4]. Les vautours étant dépendants des aigles ravisseurs pour localiser les carcasses, la conservation de l'aigle ravisseur en-dehors des zones protégées est vitale pour assurer la survie des vautours[157].
Facteurs de menaces

L'aigle ravisseur fait face à diverses menaces qui affectent sa reproduction, son nourrissage et enfin sa survie. La plus récente et la plus dévastatrice des menaces a eu lieu le 20 juin 2019. Les corps de 468 vautours africains, 17 vautours à tête blanche, 14 oricous et 10 vautours chassefiente, ainsi que ceux de 2 aigles ravisseurs, ont été retrouvés. Un total de 537 vautours et 2 aigles ravisseurs ont été empoisonnés ainsi dans le nord du Botswana, probablement après avoir consommé les carcasses de 3 éléphants qui avaient été empoisonnées par des braconniers. Les braconniers empoisonnent ces carcasses pour éviter que la présence de charognards n'avertisse les gardiens de la présence d'animaux abattus. En effet, en volant au-dessus des animaux morts, les vautours et les aigles ravisseurs constituent un système de détection efficace utilisé par les gardiens contre le braconnage[204],[205],[206],[207]. Les empoisonnements n'ont pas lieu qu'au Botswana, c'est aussi un probable facteur de disparition des aigles ravisseurs dans les zones protégées du parc national Kruger en Afrique du Sud[208]. Dans le centre de la Namibie, 5 aigles ravisseurs juvéniles qui avaient été bagués sont morts après avoir mangé des appâts empoisonnés à la strychnine, ce qui a décimé la nouvelle génération de l'espèce dans cette zone[201]. Cependant, de manière mystérieuse, les populations d'aigles ravisseurs et de bateleurs des savanes semblent remonter dans la réserve nationale du Masai Mara alors qu'elle baisse partout ailleurs, tandis que le déclin des populations de vautours s'accélère[209].
L'aigle ravisseur est également menacé par la perte de son habitat transformé par les activités humaines, comme l'élevage de bétail et la production de bois de chauffage et de charbon[6]. L'abattage d'arbres déjà peu nombreux dans les zones arides de l'Inde semble être le principal facteur du déclin des populations indiennes[4]. Des infections bactériennes de plus en plus nombreuses semblent également affecter les aigles ravisseurs en Inde[210]. Les populations de rapaces sont dépendantes des pluies saisonnières, qui influencent le développement de leurs proies[6] : le changement climatique, qui modifie le rythme des pluies dans le sud de l'Afrique, a un impact sur la population des proies de l'aigle ravisseur. Il y a une corrélation claire entre la présence de ces pluies et la reproduction des aigles ravisseurs. Le déclin des aigles ravisseurs dû au changement climatique, qui a déjà commencé, impacte d'abord la persistance des populations, puis leur dynamique, puis la composition des communautés biologiques, et enfin, la biodiversité[6],[211]. Les électrocutions et les collisions avec des pylônes électriques sont une autre menace pour les aigles et les vautours ; de plus, la présence de nids sur les pylônes peut causer des pannes d'électricité importantes[190],[212]. L'aigle ravisseur peut aussi entrer en collision avec d'autres structures artificielles comme les barrages, ou peut être victime du trafic routier, ou des éoliennes, en particulier en Inde[201],[213],[214]. La principale menace pour l'aigle ravisseur et les autres rapaces est la croissance de la population humaine, qui les concurrence pour le territoire et la nourriture[62].
La clé de la conservation des populations d'aigles ravisseurs est la limitation du réchauffement climatique[6],[215],[216],[217],[218], ainsi que l'interdiction des appâts empoisonnés et la limitation de la présence de lignes électriques sur leurs territoires[201],[205],[190].
Notes et références
- (en) Helbig, A. J., Kocum, A., Seibold, I., & Braun, M. J. (2005). A multi-gene phylogeny of aquiline eagles (Aves: Accipitriformes) reveals extensive paraphyly at the genus level. Molecular phylogenetics and evolution, 35(1), 147-164.
- (en) J. Ferguson-Lees et D. Christie, Raptors of the World, Houghton Mifflin Harcourt, (ISBN 0-618-12762-3)
- (en) Hustler, K., & Howells, W. W. (1989). Habitat preference, breeding success and the effect of primary productivity on Tawny Eagles Aquila rapax in the tropics. Ibis, 131(1), 33-40.
- (en) R. Naoroji et N.J. Schmitt, Birds of prey of the Indian subcontinent, Om Books International,
- (en) Leslie Brown et Dean Amadon, Eagles, Hawks and Falcons of the World, The Wellfleet Press, (ISBN 978-1555214722).
- (en) M. Wichmann, W. Dean et F. Jeltsch, Global change challenges the Tawny Eagle (Aquila rapax): Modelling extinction risk with respect to predicted climate and land-use changes, vol. 75, , 204–210 p. (DOI 10.2989/00306520409485446, S2CID 85057659), chap. 4
- (en) BirdLife International, « Aquila rapax », (consulté le )
- (en) Ogada, D. L. (2014). The power of poison: pesticide poisoning of Africa’s wildlife. Annals of the New York Academy of Sciences, 1322(1), 1-20.
- (nl) Temminck, C. J. (1828). Blik op de dierlijke bewoners van de Sunda-eilanden en van de overige Nederlandsche bezittingen in Indië. Bijdr. nat. Wetensch, 3, 64-78.
- (en) Frank Gill et David Donsker, « New World vultures, Secretarybird, kites, hawks & eagles », sur World Bird List Version 9.2, International Ornithologists' Union, (consulté le )
- (en) P. Steyn, Birds of prey of southern Africa: Their identification and life histories, Beckenham, Croom Helm,
- (en) L. Brown, Eagles of the World, Universe Books,
- (en) Li, Q., Lin, J., Li, S., Wang, Y., Li, W., & Zeng, Y. (2000). Studies on the evolution of mitochondrial DNA in 11 species of Accipitridae. Dong wu xue bao.[Acta zoologica Sinica], 46(2), 209-220.
- (en) De Boer, L. E. M., & Sinoo, R. P. (1984). A karyological study of Accipitridae (Aves: Falconiformes), with karyotypic descriptions of 16 species new to cytology. Genetica, 65(1), 89-107.
- (en) Väli, Ü. (2002). Mitochondrial pseudo‐control region in old world eagles (genus Aquila). Molecular Ecology, 11(10), 2189-2194.
- (en) Lerner, H. R., & Mindell, D. P. (2005). Phylogeny of eagles, Old World vultures, and other Accipitridae based on nuclear and mitochondrial DNA. Molecular phylogenetics and evolution, 37(2), 327-346.
- (en) Jeff Watson, The Golden Eagle, A&C Black, (ISBN 978-1-4081-1420-9, lire en ligne)
- (en) Stresemann, E., & Amadon, D. (1979). Order Falconiformes. Check-list of birds of the world, 1, 271-425.
- (en) Howard, R., & Moore, A. (1991). A complete checklist of the birds of the world (No. Ed. 2). Academic Press Ltd..
- (en) W.S. Clark, « The taxonomy of Steppe and Tawny Eagles, with criteria for separation of museum specimens and live eagles », Bull. B.O.C., vol. 112, no 3, , p. 150–157 (lire en ligne)
- (en) S.L. Olson, « Cranial osteology of Tawny and Steppe Eagles Aquila rapax and A. nipalensis », Bull. B.O.C., vol. 114, , p. 264–267 (lire en ligne)
- (en) G. Sangster, A.G. Knox, A.J. Helbig et D.T. Parkin, « Taxonomic recommendations for European birds », Ibis, vol. 144, no 1, , p. 153–159 (DOI 10.1046/j.0019-1019.2001.00026.x)
- (en) Amadon, D., & Short, L. L. (1976). Treatment of subspecies approaching species status. Systematic Zoology, 25(2), 161-167.
- (en) Brooke, R. K., Grobler, J. H, Irwin, M. P. S., & Steyn, P. (1972). A study of the migratory eagles Aquila nipalensis and A. pomarina (Aves:Accipitridae) in Southern Africa, with comparative notes on other large raptors. Occ. Papers of the Nat. Mus. of Rhodesia B5(2): 61–114.
- (en) Global Raptors
- (en) White, C. M., Olson, P. D., & Kiff, L. F. (1994). Family Falconidae (hawks and eagles). Handbook of the birds of the world, 2: 52-214.
- (en) Kemp, A.C. and G. M. Kirwan (2020). Tawny Eagle (Aquila rapax), version 1.0. In Birds of the World (J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, and E. de Juana, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA.
- (en) Ash, C. P., & Atkins, J. D. (2009). Birds of Ethiopia and Eritrea: an atlas of distribution. A&C Black.
- (en) Musindo, P. T. (2012). Morphological variation in bills and claws in relation to Prey type in Southern African Birds of Prey (Orders Falconiformes and Strigiformes).
- (en) Clouet, M., Barrau, C., & Goar, J. L. (2000). The diurnal Afro-alpine raptor community of the Ethiopian Balé Highlands. Ostrich, 71(3-4), 380-384.
- (en)Cook, W. E. (2012). Avian desert predators. Springer Science & Business Media.
- (en) Al-Sheikhly, O. F., & Al-Azawi, A. J. (2019). The Diurnal Birds of Prey (Raptors) in the Mesopotamian Marshes of Southern Iraq with notes on their Conservation Status. Bulletin of the Iraq Natural History Museum (ISSN 1017-8678 et 2311-9799), 15(4), 381-402.
- (en) Crochet, P. A., Raty, L., De Smet, G., Anderson, B., Barthel, P. H., Collinson, J. M., Dubois P.J., Helbig, A.J., Jiguet, F., Jirle, E., Knox, A.G., Le Maréchal, P., Parkin, D.T., Pons, J.-M., Roselaar C.S.,Svensson, L., van Loon, A.J., & Yésou P. (2010). AERC TAC’s taxonomic recommendations. July 2010. Disponible sur: http://www. aerc. eu/tac. html.
- (en) C.G. Sibley et B.L. Monroe, Distribution and Taxonomy of Birds of the World, Yale University Press,
- (en) S. Ali et S.D. Ripley, Handbook of the birds of India and Pakistan, together with those of Bangladesh, Nepal, Bhutan, and Sri Lanka, Oxford University Press,
- (en) E.C. Baker, Fauna of British India including Ceylon and Burma, Taylor & Francis,
- (en) Salim Ali, The Book of Indian Birds, Bombay, Bombay Natural History Society, (ISBN 0-19-563731-3)
- (en) Shirihai, H. (1994). Separation of Tawny Eagle from Steppe Eagle in Israel. British Birds, 87, 396-397.
- (en) Snelling, J. C. (1969). Some information obtained from marking large raptors in the Kruger National Park, Republic of South Africa. Ostrich, 40(S1), 415-427.
- (en) John B. Dunning Jr, CRC Handbook of Avian Body Masses, 2nd Edition, CRC Press, (ISBN 978-1-4200-6444-5)
- (en) N. Borrow et R. Demey, R, Field guide to the birds of Ghana, Bloomsbury Publishing,
- (en) B. Van Perlo, Birds of southern Africa, Harpercollins Pub Limited,
- « Tawny eagle (Aquila rapax) » [archive du ], sur ARKive,
- (en) Mendelsohn, J. M., Kemp, A. C., Biggs, H. C., Biggs, R., & Brown, C. J. (1989). Wing areas, wing loadings and wing spans of 66 species of African raptors. Ostrich, 60(1), 35-42.
- (en) Anderson, D. J., & Horwitz, R. J. (1979). Competitive interactions among vultures and their avian competitors. Ibis, 121(4), 505-509.
- (en) P.A.R. Hockey, W.R.J. Dean et P.G. Ryan, Roberts - Birds of southern Africa, VIIth ed., Cape Town, The Trustees of the John Voelcker Bird Book Fund,
- (en) Smeenk, C. (1974). Comparative-ecological studies of some East African birds of prey. Ardea 62 (1-2) : 1-97.
- (en) A. Kemp et M. Kemp, Sasol Birds of Prey; New Edition, Struik,
- (en) D. Forsman, The raptors of Europe and the Middle East: a handbook of field identification, Londres, T & AD Poyser,
- (en) Jankowitz, M. (1976). Tawny or Steppe Eagle. Bokmakierie, 28(3), 64-65.
- (en) Davidson, I. (1978). Flight identification of southern African raptors. Bokmakierie, 30: 43-48.
- (en) P. Steyn, « Observations on the Tawny Eagle », Ostrich, vol. 44, no 1, , p. 1–22 (DOI 10.1080/00306525.1973.9632611)
- (en) Davison, B. (1998). Raptor communities in hill habitats in south-eastern Zimbabwe (Doctoral dissertation, Rhodes University).
- P. Isenmann et A. Moali, Oiseaux d'Algérie, Paris, Société d‟Etudes Ornithologiques de France, (ISBN 2-9506548-8-6)
- (en) G. Nikolaus, Distribution atlas of Sudan's birds with notes on habitat and status, Zoologisches Forschungsinstitut und Museum Alexander Koenig,
- (en) Smith, K. D. (1957). An annotated check list of the birds of Eritrea. Ibis, 99(2), 307-337.
- (en) J.S. Ash et J.E. Miskell, Birds of Somalia, Pica Press,
- (en) M. Thévenot, R. Vernon et P. Bergier, The birds of Morocco: an annotated checklist(No. 20), British Ornithologists' Union,
- P. Isenmann, Oiseaux de Tunisie, Société d'études ornithologiques de France, Muséum national d'histoire naturelle,
- (en) N. Borrow et R. Demey, A guide to the birds of western Africa, NJ, Princeton,
- (en) M.E.J. Gore, Birds of the Gambia . Checklist 3, British Ornithologists' Union, Tring,
- (en) J.M. Thiollay, The birds of Ivory Coast: status and distribution, West African Ornithological Society,
- (en) Greig-Smith, P. W. (1976). The composition and habitat preferences of the avifauna of Mole National Park, Ghana. Bull. Nigerian Orn. Soc, 12(42), 45-66.
- (en) Dowsett, R. J., Dowsett-Lemaire, F., & Hester, A. (2008). The avifauna of Ghana: additions and corrections. Bull. Afr. Bird Club, 15, 191-200.
- (en) R.A. Cheke et J.F. Walsh, The birds of Togo: an annotated check-list (No. 14), British Ornithologists' Union,
- (en) J.H. Elgood, J.B. Heigham, A.M. Moore, A.M. Nason, R.E. Sharland et N.J. Skinner, The birds of Nigeria: an annotated check-list, British Ornithologists' Union,
- (en) M. Carswell, D. Pomeroy, J. Reynolds et H. Tushabe, The Bird Atlas of Uganda, British Ornithologists’ Club and British Ornithologists’ Union,
- (en) F. Dowsett-Lemaire et R.J. Dowsett, The birds of Malawi: an atlas and handbook, Tauraco & Aves,
- (en) T. Stevenson et J. Fanshawe, Field guide to the birds of East Africa, T & AD Poyser,
- (en) R.J. Dowsett, D.R. Aspinwall et F. Dowsett-Lemaire, The birds of Zambia: an atlas and handbook, Tauraco Press,
- (en) W.R.J. Dean, The birds of Angola: an annotated checklist, British Ornithologists' Union,
- (pt) A.A. da Rosa Pinto, Ornitologia de Angola (Vol. 1), Instituto de Investigação Científica Tropical,
- (en) V. Parker, The atlas of the birds of central Mozambique, Endangered Wildlife Trust and the Avian Demography Unit,
- (en) M.P.S. Irwin, The birds of Zimbabwe, Quest Pub.,
- (en) H. Penry, Bird atlas of Botswana, University of Kwazulu Natal Press,
- (en) Hancock, P., Muller, M., & Tyler, S. J. (2007). Inventory of Birds of the Okavango Delta Ramsar Site. Babbler, 49, 3-29.
- (en) K.N. Barnes, The Eskom red data book of birds of South Africa, Lesotho and Swaziland, BirdLife South Africa,
- (en) Boshoff, A. F., & Vernon, C. J. (1980). The distribution and status of some eagles in the Cape Province. Annals of the Cape Provincial Museums (Natural History), 13(9), 107-132.
- (en) Monadjem, A., & Rasmussen, M. W. (2008). Nest distribution and conservation status of eagles, selected hawks and owls in Swaziland. Gabar, 19, 1-22.
- (en) Jennings, M. C. (1991). The changing avifauna of Saudi Arabia. Journal of Saudi Arabian Natural History Society, 3, 16-28.
- (en) R.P. Martins et R.F. Porter, Southern Yemen and Socotra: The Report of the OSME Survey in the Spring 1993, Ornithological Society of the Middle East,
- (en) H. Shirihai, E. Dovrat, D.A. Christie et A. Harris, The birds of Israel, Londres, Academic Press,
- (en) J. Eriksen, D.E. Sargeant et R. Victor, Oman Bird List (6th Edition), Muscat, Oman, Centre for Environmental Studies & Research, Sultan Qaboos University,
- (en) Rasmussen, P. C., & Anderton, J. C. (2005). Birds of south Asia: the Ripley guide. Washington, DC.
- (en) Scott, D. A., & Adhami, A. (2006). An updated checklist of the birds of Iran. Podoces, 1(1/2), 1-16.
- (en) Roth, T., Ayé, R., Burri, R., & Schweizer, M. (2005). Bird observations from Iran in February–March 2001, including a new species for the Middle East. Sandgrouse, 27: 63-68.
- (en) C. Inskipp et T. Inskipp, A guide to the birds of Nepal. Second edition, Londres, Christopher Helm,
- (en) Donald, C. H. (1919). Some birds of prey of Mesopotamia. Journal of the Bombay Natural History Society, 26: 845-846.
- (en) Duckworth, J. W., Inskipp, T. P., Pasquet, E., Rasmussen, P. C., Rice, N. H., Robson, C. R., & Russell, D. G. D. (2008). A re-evaluation of the status of Tawny Eagle Aquila rapax in South-East Asia.
- (en) D. Warakagoda, Photographic Guide to the Birds of Sri Lanka, A & C Black Limited,
- (en) Fry, C. H. (1966). The ecological distribution of birds in northern Guinea savanna, Nigeria. Ostrich, 37 (1): 335-356.
- (en) Hustler, K., & Howells, W. W. (1990). The influence of primary production on a raptor community in Hwange National Park, Zimbabwe. Journal of Tropical Ecology, 6(3), 343-354.
- (en) J. Herhold, A. Kemp et D. Du Plessis, « Aspects of the breeding status and ecology of the Bateleur and Tawny Eagle in the Kalahari Gemsbok National Park, South Africa », Ostrich, vol. 67, nos 3–4, , p. 126–137 (DOI 10.1080/00306525.1996.9639697)
- (en) Malan, G., & Howells, B. (2009). Tree nest surveys. Raptor Survey and Monitoring: A Field Guide for African Birds of Prey, 42.
- (en) Thiollay, J. M. (1992). Patterns and ecology of seasonal migrations of Ethiopian raptors in West Africa. In 7th Pan-African Ornithological Congress, Nairobi (Vol. 28).
- (en) Snelling, J. C. (1970). Some information obtained from marking large raptors in the Kruger National Park, Republic of South Africa. Ostrich suppl., 8: 415-427.
- (en) Ławicki, Ł., Jiguet, F., El Din, S. B., van den Berg, A. B., Corso, A., Crochet, P. A., Hoath, R., Schweizer, M. & Waheed, A. (2019). Sixth report of the Egyptian Ornithological Rarities Committee.
- (en) P.K. Arnold, Birds of Israel, Shalit Publishers,
- (en) Kinnear, N. B. (1931). On some birds from central South Arabia. Ibis, 73(4), 698-701.
- (en) Jahan, I., Thompson, P. M., Paul, E., Sultana, N., Roy, K., & Mallick, A. (2017). Birds of Bhawal National Park, Bangladesh. Forktail, (33), 88-91.
- (en) Oatley, T.B., Oschadleus, H.D., Navarro, R.A. & Underhill, L.G. (1998). Review of ring recoveries of birds of prey in southern Africa: 1948–1998. Endangered Wildlife Trust, Johannesburg.
- (en) Wichmann, M. C., Groeneveld, J., Jeltsch, F., & Grimm, V. (2005). Mitigation of climate change impacts on raptors by behavioural adaptation: ecological buffering mechanisms. Global and Planetary Change, 47(2-4), 273-281.
- (en) M. Shakil, The Eagles of Kashmir, Auto-édite,
- (en) Dharmakumarsinhji, R.S. (1949). Birds of prey as companions. Avicultural Magazine, 55: 81-85.
- (en) Ellis, D. H., Bednarz, J. C., Smith, D. G., & Flemming, S. P. (1993). Social Foraging Classes in Raptorial Birds: Highly developed cooperative hunting may be important for many raptors. Bioscience, 43(1), 14-20.
- (en) Barbour, D. (1975). Do Eagles use moonlight to hunt? Honeyguide, 82: 37.
- (en) T. Osborne, « Observations on the Tawny Eagle in Southern Zambia », Ostrich, vol. 53, no 2, , p. 107–111 (DOI 10.1080/00306525.1982.9634734)
- (en) Vernon, C. J. (1979). Prey remains from seven Tawny Eagle nests. Honeyguide, 100: 22-24.
- (en) Tarboton, W.R. & Allan, D.G. (1984). The status and conservation of birds of prey in the Transvaal. Transvaal Museum Monograph No. 3. Pretoria.
- (en) Boshoff, A. F., Rous, R. C., & Vernon, C. J. (1981). Prey of the tawny-eagle in the colesberg district, Cape Province. Ostrich, 52(3), 187-188.
- (de) Muller, J. P. 1977. Populationsokologie von Arvicanthis abyssinicus in der Grassteppe des Semien Mountain National Park (Athiopien). Z. Saugetierk, 42 (3): 145-172.
- (en) V.G.L. Van Someren, Days with birds: studies of habits of some East African species (Vol. 38), Chicago Natural History Museum,
- (en) K.S. Dharmakuarsinhji, Birds of Saurashtra, Dil Bahar,
- (en)Fitzwater, W. D., & Prakash, I. (1969). Observations on the burrows, behavior and home range of the Indian desert gerbil, Meriones hurrianae Jerdon. Mammalia, 33(4), 598-606
- (en) I. Prakash et P.K. Ghosh, Rodents in desert environments (Vol. 28), Springer Science & Business Media,
- (en) Giban, J. (1978). Control of the multimammate rat, Mastomys natalensis (A. Smith) in the irrigated fields of the Republic of Burundi. In Proceedings of the 8th Vertebrate Pest Conference (1978) (p. 20).
- (en) J. Kingdon, D. Happold, T. Butynski, M. Hoffmann, M. Happold et J. Kalina, Mammals of Africa, A&C Black,
- (en) Mbise, F. P., Fredriksen, K. E., Fyumagwa, R. D., Holmern, T., Jackson, C. R., Fossøy, F., & Røskaft, E. (2017). Do hyraxes benefit from human presence in Serengeti? African journal of ecology, 55(4), 672-678.
- (en) Dean, W. R. J., Huntley, M. A., Huntley, B. J., & Vernon, C. J. (1988). Notes on some birds of Angola. Novitates, Durban Museum, 14(4), 43-92.
- (en) Beynon, P., & Rasa, O. A. E. (1989). Do dwarf mongooses have a language-warning vocalizations transmit complex information? South African Journal of Science, 85(7): 447-450.
- (en) Manser, M. B., Seyfarth, R. M., & Cheney, D. L. (2002). Suricate alarm calls signal predator class and urgency. Trends in cognitive sciences, 6(2), 55-57.
- (en) W.R. Tarboton, P. Pickford et B. Pickford, African birds of prey, Cornell University Press,
- (en) Malcom, J. R. (1986). Socio‐ecology of Bat‐eared foxes (Otocyon megalotis). Journal of Zoology, 208(3), 457-469.
- (en) Mercier, S., Neumann, C., van de Waal, E., Chollet, E., de Bellefon, J. M., & Zuberbühler, K. (2017). Vervet monkeys greet adult males during high-risk situations. Animal Behaviour, 132, 229-245.
- (en) Pereira, M. E. (1988). Effects of age and sex on intra-group spacing behaviour in juvenile savannah baboons, Papio cynocephalus cynocephalus. Animal behaviour, 36(1), 184-204.
- (en) Pahad, G. (2010). Social behaviour and crop raiding in chacma baboons of the Suikerbosrand Nature Reserve (Doctoral dissertation, University of the Witwatersrand).
- (en) Zinner, D., & Peláez, F. (1999). Verreaux's eagles (Aquila verreauxi) as potential predators of hamadryas baboons (Papio hamadryas hamadryas) in Eritrea. American Journal of Primatology: Official Journal of the American Society of Primatologists, 47(1), 61-66.
- (en) Roberts, B. A. (2014). The trials of motherhood: Maternal behavior patterns and antipredatortactics in Thomson's gazelle (Gazella thomsonii), a hidingungulate (Doctoral dissertation, Princeton University).
- (en) Dixon, J. E. W. (1968). Prey of Large Raptors. Ostrich, 39(3), 203-204.
- (en) Douthwaite, R. J. (1978). Geese and Red‐knobbed Coot on the Kafue Flats in Zambia, 1970–1974. African Journal of Ecology, 16(1), 29-47.
- (en) Hosseini-Moosavi, S. M., Behrouzi-Rad, B., Karimpour, R., & Nasab, S. M. A. (2013). Breeding Biology of Collared Dove (Streptopelia decaocto) in Khuzestan Province, Southwestern Iran. Беркут, 22(1), 51-54.
- (en) Combreau, O., & Smith, T. R. (1998). Release techniques and predation in the introduction of houbara bustards in Saudi Arabia. Biological Conservation, 84(2), 147-155.
- (en) Runo, M. (2000). Tawny Eagle feeding on Red-billed Hornbill. Honeyguide, 46: 24.
- (en) Walters, J. R. (1990). Anti-predatory behavior of lapwings: field evidence of discriminative abilities. The Wilson Bulletin, 49-70.
- (en) Robinson, V. (2015). The Ecology of East African Soda Lakes: Implications for Lesser Flamingo (Phoeniconaias minor) Feeding Behavior (Ph.D. Dissertation). Leicester, England: University of Leicester.
- (en) A. Johnson et F. Cézilly, The greater flamingo, A&C Black,
- (en) Lichtenberg, E. M., & Hallager, S. (2008). A description of commonly observed behaviors for the kori bustard (Ardeotis kori). Journal of Ethology, 26(1), 17-34.
- (en) Jackson, H. D., & Slotow, R. (2002). A review of Afrotropical nightjar mortality, mainly road kills. Ostrich, 73(3-4), 147-161.
- (en) Raju Kasambe, G. (2010). Blue-tailed Bee-eaters are ‘winter migrants’ in and around Mumbai. Newsletter for Birdwatchers, 50(3), 33.
- (cs) Brojerová, J. (2013). Referenční vokalizace papouška žako kongo (Psittacus erithacus).
- (en) W.R.J. Dean, Nomadic Desert Birds: With 32 Tables, Springer Science & Business Media,
- (en) van Heerden J. (1977). Quelea predators. Bokmakierie, 29: 45.
- (en) Vernon, C. J. (1967). Some observations from the journals of KW Greenhow. Ostrich, 38(1), 48-49.
- (en) J. Parry-Jones, Eagle, Dorling Kindersley Ltd,
- (en) Brown, L. H. (1952). On the biology of the large birds of prey of the Embu district, Kenya colony. Ibis, 94(4), 577-620.
- Ramesh, M., & Sankaran, R. (2013). Natural History Observations on the Indian Spiny-tailed Lizard Uromastyx hardwickii in the Thar Desert. In Faunal Heritage of Rajasthan, India (pp. 295-310). Springer, New York, NY.
- (en) Baindur, A. (2009). The raptors and the agamid. Indian Birds, 5(1), 11-13.
- (en) Howells, W. W. (1978). Stranded fish as a food source for large birds of prey. Honeyguide, 96: 18.
- (en) Dial, K. P., & Vaughan, T. A. (1987). Opportunistic predation on alate termites in Kenya. Biotropica, 19(2), 185-187.
- (en) Bussia, E., & Wijers, M. (2013). Foraging frenzy: more than 50 raptors at a termite swarm. Biodiversity Observations, 11-18.
- (en) Anene, C., & Vajime, C. G. (1990). Parasites, parasitoids and predators of Oedaleus senegalensis Krauss (Orthoptera: Acrididae) in Nigeria. International Journal of Tropical Insect Science, 11(1), 27-34.
- (en) van Jaarsveld, J. (1987). Tawny Eagle and Whiteheaded Vulture eat together from elephant dung. Gabar, 2: 26.
- (en) Kemp, A. C., & Kemp, M. I. (1975). Observations on the White-backed Vulture Gyps africanus in the Kruger National Park, with notes on other avian scavengers. Koedoe, 18(1), 51-68.
- (en) Mulualem, G., Tesfahunage, W., & Ayalew, S. (2015). Abundance and activity pattern of avifauna in ashewa local vulture restaurant dire dawa eastern Ethiopia. International Journal of Avian & Wildlife Biology, 1(1).
- (en) P.J. Mundy, The comparative biology of southern African vultures, Johannesburg, Vulture Study Group,
- (en) Dean, W. R. J., & MacDonald, I. A. W. (1981). A review of African birds feeding in association with mammals. Ostrich, 52(3), 135-155.
- (en) D.L. 1=Ogada, A. =Monadjem, L. McNally, A. Kane et A.L. Jackson, « Vultures acquire information on carcass location from scavenging eagles », Proceedings of the Royal Society B: Biological Sciences, vol. 281, no 1793, , p. 20141072 (PMID 25209935, PMCID 4173674, DOI 10.1098/rspb.2014.1072)
- (en) Brown, C. J. (1982). The behaviour of a Tawny Eagle at carrion. Madoqua, 14 (1): 95-97.
- (en) Kendall, C. J. (2013). Alternative strategies in avian scavengers: how subordinate species foil the despotic distribution. Behavioral Ecology and Sociobiology, 67(3), 383-393.
- (en) Plaskett, G. (1972). Tawny Eagle/vulture behaviour. Witwaterstrand Bird Club News Sheet, 80: 11.
- (en) Houston, D.C. (1974). The role of griffon vultures Gyps africanus and Gys rueppellii as scavengers. J. of Zoo, London. 171: 35-46.
- (en) Pomeroy, D. E. (1975). Birds as scavengers of refuse in Uganda. Ibis, 117(1), 69-81.
- (en) Mesfin, K. (2014). Diversity and Abundance of Birds in Dbla Church Forest, Eastern Tigray, North Ethiopia. Journal of Zoology Studies, 1(5), 1-8.
- (en) Samson, A., & Ramakrishnan, B. (2017). Scavenging Mode of Vertebrate Scavengers on Domestic Buffalos Bubalus bubalis (Linnaeus, 1785) Killed by Tiger Panthera tigris and Natural Deaths in Southern India. Journal homepage: www. wesca. net, 12(1).
- (en) Lewis, A.D. (1990). Tawny Eagle Aquila rapax following a foraging pack of Hunting Dogs Lycaon pictus. Scopus, 14: 19-20.
- (en) Brockmann, H. J., & Barnard, C. J. (1979). Kleptoparasitism in birds. Animal behaviour, 27, 487-514.
- (en) Olsen, K. M. (2013). Skuas and jaegers. A&C Black.
- (en) Corre, M. L., & Jouventin, P. (1997). Kleptoparasitism in tropical seabirds: vulnerability and avoidance responses of a host species, the Red-footed Booby. The Condor, 99(1), 162-168.
- (en) Haynes, J.R. (1981). Tawny Eagle pirates food from a Dark Chanting-goshawk. Honeyguide, 50.
- (en) G. Leonardi, The lanner falcon, Italie, Giovanni Leonardi,
- (en) Kemp, A. C., & Kemp, M. I. (1980). The biology of the southern ground hornbill Bucorvus leadbeateri (Vigors)(Aves: Bucerotidae). Annals of the Transvaal Museum, 32(4), 65-100.
- (en) Kemp, M. I., & Kemp, A. C. (1978). Bucorvus and Sagittarius: Two modes of terrestrial predation. In: Proceedings of the Symposium on African Predatory Birds, Northern Transvaal Ornithological Society, Pretoria.
- (en) Watson, R. T., & Watson, C. (1987). Interspecific piracy between Tawny Eagles and Bateleurs: how common is it. Gabar, 2, 9-11.
- (en) Krueger, O. (1997). Population density and intra‐and interspecific competition of the African Fish Eagle Haliæeetus vocifer in Kyambura Game Reserve, southwest Uganda. Ibis, 139(1), 19-24.
- (en) Meyburg, B. U., & Kirwan, G. M. (2018). Eastern Imperial Eagle (Aquila heliaca). Handbook of the Birds of the World Alive (J. del Hoyo, A. Elliott, J. Sargatal, DA Christie, and E. de Juana, Editors). Lynx Edicions, Barcelona, Spain.
- (en) Clouet, M., Barrau, C. & Goar, J.L. (1999). The Golden Eagle (Aquila chrysaetos) in the Bale Mountains, Ethiopia. The Raptor Research Foundation, 33 (2): 102-109.
- (en) Sillero-Zubiri, C., & Gottelli, D. (1995). Diet and feeding behavior of Ethiopian wolves (Canis simensis). Journal of Mammalogy, 76(2), 531-541.
- (en) Ali, H. (2008). Behaviour and ecology of the House Crow (Corvus splendens) in Islamabad-Rawalpindi and Adjoining areas. University of Agriculture, Faisalabad, Pakistan.
- (en) Watson, R. T. (1986). The ecology, biology and population dynamics of the Bateleur Eagle (Terathopius ecaudatus) (Doctoral dissertation, RT Watson).
- (en) K.L. Bildstein et J. Parry-Jones, The eagle watchers: Observing and conserving raptors around the world, Cornell University Press,
- (en) Machange, R. W., Jenkins, A. R., & Navarro, R. A. (2005). Eagles as indicators of ecosystem health: Is the distribution of Martial Eagle nests in the Karoo, South Africa, influenced by variations in land-use and rangeland quality? Journal of arid environments, 63(1), 223-243.
- (en) Engel, J. I. (2011). Possible predation of a Pygmy Falcon by a Tawny Eagle in Namibia. Biodiversity Observations, 34-35.
- (en) D. Van Nieuwenhuyse, J. Genot et D. Johnson, The Little Owl: Conservation, Ecology and Behavior of Athene noctua, Cambridge, New York, Cambridge University Press,
- (en) Begg, C. M., Begg, K. S., Du Toit, J. T., & Mills, M. G. L. (2003). Sexual and seasonal variation in the diet and foraging behaviour of a sexually dimorphic carnivore, the honey badger (Mellivora capensis). Journal of Zoology, 260(3), 301-316.
- (en) Murn, C., Betchley, P., & Robert, C. (2009). Talon-locking and cartwheeling as a prelude to copulation in Tawny Eagles Aquila rapax. Gabar, 20, 12-14.
- (en) Borello, W. D., & Borello, R. M. (2004). Two incidents of talon-grappling and cartwheeling in the Tawny Eagle Aquila rapax. Ostrich-Journal of African Ornithology, 75(4), 320-321.
- (en) Simmons, R. E., & Mendelsohn, J. M. (1993). A critical review of cartwheeling flights of raptors. Ostrich, 64(1), 13-24.
- (en) Vincent, A. W. (1945). On the breeding habits of some African birds. Ibis, 87(3), 345-365.
- (en) Anderson A. (1871). Notes on the raptorial birds of India. Journal of Zoology, 44: 675-690.
- (en) A.R. Jenkins, K.H. De Goede, S. Lovelater et M. Diamond, « Brokering a settlement between eagles and industry: sustainable management of large raptors nesting on power infrastructure », Bird Conservation International, vol. 23, no 2, , p. 232–246 (DOI 10.1017/S0959270913000208, S2CID 87353945, lire en ligne, consulté le )
- (en) Maclean, G. L. (1969). The breeding seasons of birds in the south-western Kalahari. Ostrich, 40(1): 179-192.
- (en) W.R. Tarboton, M.I. Kemp et A.C. Kemp, Birds of the Transvaal, Transvaal Museum,
- (en) C.J. Kendall, D.L. Rubenstein, P.L. Slater et A. Monadjem, « An assessment of tree availability as a possible cause of population declines in scavenging raptors », Journal of Avian Biology, vol. 49, no 1, , p. 001–008 (DOI 10.1111/jav.01497, lire en ligne, consulté le )
- H.H. de Balsac et N. Mayaud, Les oiseaux du nord-ouest de l'Afrique: distribution géographique, écologie, migrations, reproduction (Vol. 10), P. Lechevalier,
- (en) D.A. Bannerman, The birds of tropical West Africa, London, Crown Agents,
- (en) D.A. Bannerman, The Birds of West and Equatorial Africa, Edinburgh & London, Oliver & Boyd,
- (en) McGowan, G. (1992). Tawny Eagle pair raise two chicks. Babbler, 23: 50.
- (en) Hustler, K., & Howells, W. W. (1986). A population study of tawny eagles in the Hwange National park, Zimbabwe. Ostrich, 57(2), 101-106.
- (en) S.S. Flower, List of Birds of Prey 1898-1923: With Notes on Their Longevity, Government Press,
- (en) L. Underhill et M. Brooks, « Preliminary summary of changes in bird distributions between the first and second southern African Bird Atlas projects (SABAP AND SABAP2) », Ornithological Observations, vol. 5, , p. 258–293 (lire en ligne, consulté le )
- (en) Brown, C. J. (1991). Declining Martial Polemaetus bellicosus and Tawny Aquila rapax Eagle populations and causes of mortality on farmlands in central Namibia. Biological conservation, 56(1), 49-62.
- (en) Herholdt, J. J. (1998). Survival threats and conservation management of raptors in the Kgalagadi Transfrontier Park. Transactions of the Royal Society of South Africa, 53(2), 201-218.
- (en) J. Thiollay, « The decline of raptors in West Africa : long-term assessment and the role of protected areas », Ibis, vol. 148, no 2, , p. 240–254 (DOI 10.1111/j.1474-919X.2006.00531.x)
- (en) « Over 500 Rare Vultures Die After Eating Poisoned Elephants In Botswana », sur NDTV, Agence France-Presse, (consulté le )
- (en) Ella Hurworth, « More than 500 endangered vultures die after eating poisoned elephant carcasses », sur CNN, (consulté le )
- (en) Meilan Solly, « Poachers' Poison Kills 530 Endangered Vultures in Botswana », Smithsonian, (lire en ligne, consulté le )
- (en) Boris Ngounou, « BOTSWANA: Over 500 vultures found dead after massive poisoning », Afrik21, (consulté le )
- (en) Loftie-Eaton, M. (2014). Geographic range dynamics of South Africa’s bird species. South Africa: Department of Biological Sciences, University of Cape Town.
- (en) Virani, M. Z., Kendall, C., Njoroge, P., & Thomsett, S. (2011). Major declines in the abundance of vultures and other scavenging raptors in and around the Masai Mara ecosystem, Kenya. Biological Conservation, 144(2), 746-752.
- (en) Dutta, T. K., Sudhan, N. A., & Azmi, S. (2008). PCR detection of Pasteurella multocida in eagle PCR based detection, characterization and antibiogram of Pasteurella multocida from wild eagle (Aquila rapax) in Jammu and Kashmir. The Indian Journal of Animal Sciences, 78(12).
- (en) Wichmann, M. C., Jeltsch, F., Dean, W. R. J., Moloney, K. A., & Wissel, C. (2003). Implication of climate change for the persistence of raptors in arid savanna. Oikos, 102(1), 186-202.
- (en) Van Rooyen, C. S. (2000). Raptor mortality on power lines in South Africa. In Raptors at risk: proceedings of the 5th world conference on birds of prey and owls. Hancock House Publishers and the World Working Group on Birds of Prey and Owls, Blaine, Washington (pp. 739-750).
- (en) Anderson, M. D., Maritz, A. W., & Oosthuysen, E. (1999). Raptors drowning in farm reservoirs in South Africa. Ostrich, 70(2), 139-144.
- (en) Pande, S., Padhye, A., Deshpande, P., Ponkshe, A., Pandit, P., Pawashe, A., Pednekar , S., Pandit, R. & Deshpande, P. (2013). CEPF Western Ghats Special Series: Avian collision threat assessment at Bhambarwadi Wind Farm Plateau in northern Western Ghats, India. Journal of Threatened Taxa, 5(1), 3504-3515.
- (en) Crick, H. Q., & Sparks, T. H. (1999). Climate change related to egg-laying trends. Nature, 399(6735), 423-423.
- (en) Aumann, T. (2001). The structure of raptor assemblages in riparian environments in the south-west of the Northern Territory, Australia. Emu, 101(4), 293-304.
- (en) Post, E., Peterson, R. O., Stenseth, N. C. & McLaren, B. E. (1999). Ecosystem consequences of wolf behavioural responses to climate. Nature, 401: 905–907.
- (en) Moss, R., Oswald, J., & Baines, D. (2001). Climate change and breeding success: decline of the capercaillie in Scotland. Journal of Animal Ecology, 47-61.
Liens externes
- (fr) Référence Oiseaux.net : Aquila rapax (+ répartition)
- (en) Référence Zoonomen Nomenclature Resource (Alan P. Peterson) : Aquila rapax dans Accipitriformes
- (en) Référence Congrès ornithologique international :
- (fr+en) Référence Avibase : Aquila rapax (Temminck, 1828) (+ répartition) (consulté le )
- (en) Référence Fauna Europaea : Aquila rapax
- (fr+en) Référence ITIS : Aquila rapax (Temminck, 1828)
- (en) Référence Animal Diversity Web : Aquila rapax
- (en) Référence NCBI : Aquila rapax (taxons inclus)
- (en) Référence UICN : espèce Aquila rapax (Temminck, 1828) (consulté le )
- (en) Référence CITES : espèce Aquila rapax (Temminck, 1828) (+ répartition sur Species+) (consulté le )
- Portail de l'ornithologie