Aluminosilicate
Les aluminosilicates sont des minéraux du groupe des silicates dans lesquels certains atomes de silicium Si sont remplacés par des atomes d'aluminium Al. Ces substitutions s'observent dans les familles des phyllosilicates et des tectosilicates[note 1].
Certains tétraèdres (SiO4) du squelette de ces minéraux sont ainsi remplacés par des tétraèdres (AlO4).
Remarques :
- toutes les fois que deux tétraèdres sont liés par un atome d'oxygène, le centre d'un seul d'entre eux peut être occupé par un aluminium, l'autre centre devant être occupé par un silicium[note 2] ;
- les silicates d'aluminium, dans lesquels les atomes d'aluminium Al ne remplacent pas des atomes de silicium, n'appartiennent pas à la famille des aluminosilicates. Exemples : kaolinite (et la constitution d'un feuillet), pyrophyllite.
Structure des aluminosilicates
La structure des aluminosilicates (variantes : alumino-silicates, silico-aluminates[note 3]) résulte du remplacement de certains atomes de silicium Si des silicates par des atomes d'aluminium Al. La substitution de l'anion (SiO4)4− par l'anion (AlO4)5− entraîne un déficit de charge positive qui est compensé par l'introduction de cations supplémentaires pour assurer la neutralité électrique de l'ensemble.
La charpente des aluminosilicates est constituée de macroanions[note 4] à extension indéfinie (structures polymères) dont les charges négatives sont compensées par celles de cations disposés, avec les macro-anions, selon une géométrie donnée.
Appartiennent à la famille des aluminosilicates :
- les micas, à la structure en feuillets (phyllosilicates, bidimensionnels) ;
- les feldspaths, les feldspathoïdes et les zéolithes (tectosilicates, tridimensionnels).
Quelques exemples
Le remplacement à intervalles réguliers de certains atomes de silicium par des atomes d'aluminium conduit à des macroanions caractérisés par la répétition d'un motif de constitution déterminée.
Silicates bidimensionnels (phyllosilicates)
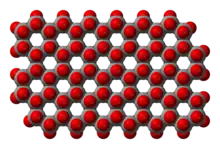
>[Si2O52−]n
(O en rouge, Si en gris)
Le motif constitutif des macroanions de ces silicates est Si2O52− (cf. les structures polymères des silicates).
La substitution d'un silicium sur quatre par un aluminium dans les macroanions de ce type conduit à des macroanions bidimensionnels de motif (AlSi3O10)5−. Associés à des cations sodium Na+, aluminium Al3+ et des ions hydroxyde OH−, ils forment le mica paragonite NaAl2(OH)2AlSi3O10.
Repliées, les feuilles de silicates bidimensionnels peuvent former des nanotubes[1].
Silicates tridimensionnels (tectosilicates)

(variété de silice cristallisée)
La famille des tectosilicates comprend les diverses variétés de silice cristallisée (quartz, tridymite, cristobalite, coésite) et les aluminosilicates tridimensionnels.
La structure de ces aluminosilicates dérive de celle de la silice cristallisée par le remplacement d'une partie des atomes de silicium par des atomes d'aluminium. Des ions (SiO4)4− sont ainsi remplacés par des ions (AlO4)5−.
Ces substitutions transforment la silice SiO2 électriquement neutre en un macroanion tridimensionnel à l'intérieur duquel les oxygènes chargés négativement fixent par attraction électrostatique des cations métalliques. Ces anions géants forment l'armature rigide de l'édifice cristallin à l'intérieur duquel les cations métalliques ne jouent qu'un rôle secondaire[note 5].
- macroanion tridimensionnel, de motif AlSi3O8−
- Associé à des cations potassium K+, il forme l’orthose KAlSi3O8
- Associé à des cations sodium Na+, il forme l’albite NaAlSi3O8
- macroanion tridimensionnel, de motif AlSiO4−

(macromolécules [SiO2]n)

(macroanions [AlSi3O8−]n + cations Na+)
sur quartz
Notes
- Voir notamment A. Michel - J. Bénard, op. cit., p. 361 et Jacques Angenault, op. cit., p. 516.
- C. A. Jouenne, op. cit., p. 203.
- Maurice Bernard, op. cit., p. 262-263 (alumino-silicates) ; Raymond Quelet, Tome 2, op. cit., p. 74 (silico-aluminates).
- Raymond Quelet, op. cit., Tome 1, p. 190-192 et Maurice Bernard, op. cit., p. 261-263.
- Raymond Quelet, op. cit., Tome 1, p. 192.
Voir aussi
Bibliographie
- Jean P. Mercier, Gérald Zambelli, Wilfried Kurz, Traité des matériaux, Vol.1 - Introduction à la science des matériaux, 3e éd., Presses polytechniques et universitaires romandes, 1999 (ISBN 2-88074-402-4).
- Maurice Bernard, Cours de chimie minérale, 2e éd., Éditions Dunod, 1994 (ISBN 2-10-002067-6).
- André Guinier, La structure de la matière – du ciel bleu à la matière plastique, Éditions Hachette, 1980 (ISBN 2-01-007095-X).
- A. Michel - J. Bénard, Chimie minérale, Éditions Masson, 1964.
- Raymond Quelet, Précis de chimie, Tome 1 - Chimie générale, 9e éd., Presses universitaires de France, 1966.
- Raymond Quelet, Précis de chimie, Tome 2 - Chimie minérale, 8e éd., Presses universitaires de France, 1964.
- Huheey, Keiter & Keiter, Chimie inorganique, De Boeck Université, 1996 (ISBN 2-8041-2112-7)
- C. A. Jouenne, Traité de Céramiques et Matériaux Minéraux, Éditions Septima, Paris, 1990.
- Jacques Angenault, La Chimie – dictionnaire encyclopédique, 2e édition, Éditions Dunod, 1995 (ISBN 2100024973).
Articles connexes
Liens externes
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Portail de la géologie
- Portail des minéraux et roches
- Portail de la chimie