Aniline
L’aniline, connue également sous les noms de aminobenzène, phénylamine ou benzèneamine, est un composé organique aromatique de formule chimique C6H5-NH2.
| Aniline | |
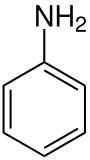 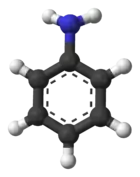 Structure de l'aniline. |
|
| Identification | |
|---|---|
| Nom UICPA | aniline |
| Synonymes |
phénylamine |
| No CAS | |
| No ECHA | 100.000.491 |
| No CE | 200-539-3 |
| PubChem | 6115 |
| ChEBI | 17296 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, huileux, d'odeur caractéristique. Devient brun lors d'exposition à l'air ou la lumière[1]. |
| Propriétés chimiques | |
| Formule | C6H7N [Isomères] |
| Masse molaire[2] | 93,126 5 ± 0,005 5 g/mol C 77,38 %, H 7,58 %, N 15,04 %, |
| pKa | 4,6 à 25 °C[3] |
| Moment dipolaire | 1,13 ± 0,02 D[4] |
| Diamètre moléculaire | 0,562 nm[5] |
| Propriétés physiques | |
| T° fusion | −6,0 °C[6] |
| T° ébullition | 184,1 °C[6] |
| Solubilité | 34 g l−1 (eau, 20 °C)[1] ; 3,5 parts/100 parts (eau, 25 °C) ; |
| Paramètre de solubilité δ | 21,1 MPa1/2 (25 °C)[7] ; 24,1 J1/2·cm-3/2 (25 °C)[5] |
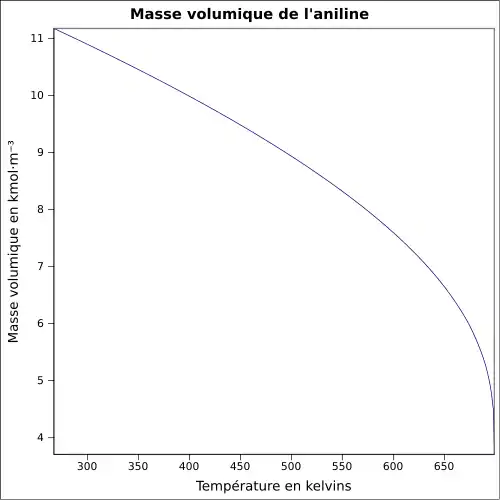
| Masse volumique | 1,02 g cm−3[1], Densité du gaz : 3,2 (air = 1) |
| T° d'auto-inflammation | 615 °C[1] |
| Point d’éclair | 70 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 1,2–11 %vol[1] |
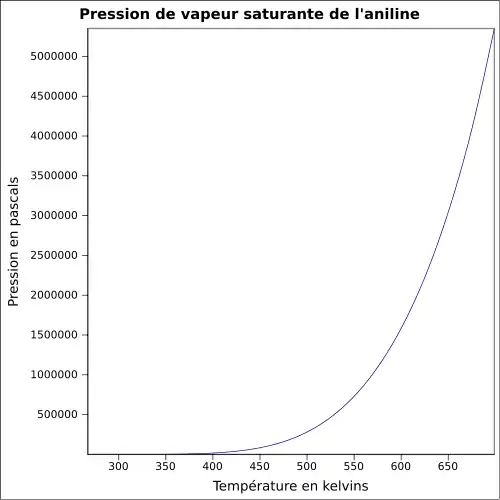
| Pression de vapeur saturante | à 20 °C : 40 Pa[1]
|
| Viscosité dynamique | 3,71 cP à 25 °C |
| Point critique | 53,1 bar, 425,85 °C[9] |
| Thermochimie | |
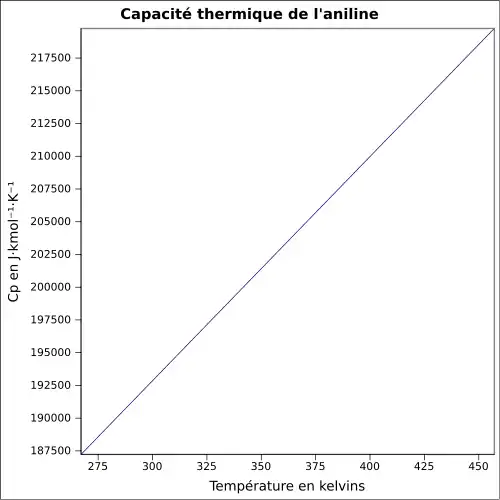
| Cp | |
| PCS | 3 392,8 kJ mol−1 (25 °C, liquide)[11] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P21/c[12] |
| Paramètres de maille | a = 21,822 Å b = 5,867 Å |
| Volume | 1 053,89 Å3[12] |
| Propriétés optiques | |
| Indice de réfraction | 1,586 3[6] |
| Précautions | |
| SGH[13] | |
    Danger |
|
| SIMDUT[14] | |
  B3, D1A, D2B, |
|
| NFPA 704 | |
| Transport | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[15] | |
| Inhalation | Vertiges, convulsions, vomissements, perte de conscience |
| Peau | Rougeurs |
| Yeux | Rougeur, douleur |
| Ingestion | Toxique |
| Écotoxicologie | |
| LogP | 0,94[1] |
| DJA | 7 μg/kg p.c. par jour[16] |
| Seuil de l’odorat | bas : 0,58 ppm haut : 10 ppm[17] |
| Unités du SI et CNTP, sauf indication contraire. | |
C'est une amine primaire aromatique dérivée du benzène, toxique pour l'homme et l'environnement. Parmi ses dérivés, on compte les chloroanilines, dichloroanilines, trichloroanilines…
L'aniline a été, au XIXe siècle, à la base du développement de l'industrie des colorants de synthèse, regroupés au début sous le nom de Teerfarben (en français « colorants de goudron »). Ces dérivés de l'aniline ont servi pour produire une grande quantité de bleus, violets, mauves et rouges, et quelques noirs, bruns et verts.
Historique
Otto Unverdorben, distillant de l'indigo, isola en 1826 un produit qu'il appela krystalline. En 1834, Friedlieb Runge parvint à isoler du goudron de houille une substance qui une fois traitée par du chlorure de chaux prend une couleur bleue, qu'il nomma kyanol ou cyanol.
En 1841, Carl Julius Fritzsche obtint en traitant de l'indigo avec de la potasse une substance huileuse qu'il désigna, le premier, sous le nom d’aniline, d'après le nom latin de la plante produisant de l'indigo, Indigofera anil. Le mot « anil » est lui-même issu des termes sanskrits nīla, bleu profond, et nīlā plante d'indigo. À peu près en même temps, Nikolaï Zinine découvrit que la réduction du nitrobenzène permet d'obtenir une base qu'il baptisa benzidam.
August Wilhelm von Hofmann démontra en 1855 que ces substances sont identiques.
En 1856, William Henry Perkin, un jeune élève de Hofmann, cherchait un moyen de synthétiser la quinine. Il n'y parvint pas mais il mit au point, à dix-huit ans, le premier colorant violet à base d'aniline, la mauvéine, qui entraîna la première utilisation d'aniline à l'échelle industrielle[18].
En Allemagne, la production des « couleurs de charbon » ou « de goudron » ou « de houille » (en allemand Teerfarben) lance une grande industrie dont le nom s'associe à l'aniline : Badische Anilin- & Soda-Fabrik (BASF).
Propriétés physico-chimiques
Dans les conditions normales, l'aniline est un liquide huileux incolore, d'odeur désagréable, et facilement inflammable. Elle s'oxyde lentement au contact de l'air, pour former une résine de couleur brun-rouge.
L'aniline est une base faible. La délocalisation du doublet non-liant de l'atome d'azote sur le cycle aromatique fait que la forme protonée de l'aniline est moins favorisée que dans le cas des amines aliphatiques (plus basiques). Elle réagit avec les acides forts en formant des sels contenant l'ion anilinium (C6H5–NH3+). Elle réagit également avec les halogénures d'acyle (par exemple le chlorure d'éthanoyle) en formant des amides. Les amides formés à partir de l'aniline sont parfois nommés anilides, comme l'acétanilide.
L'aniline, comme toutes les amines, est facilement oxydable. Son oxydation est catalysée par la lumière, la chaleur et les impuretés métalliques et permet la formation de l'azobenzène, composé azoïque coloré. Une fois oxydée, l'aniline prend une couleur brune. Cette réaction impose la conservation de l'aniline dans des flacons bruns, éventuellement sous azote, au frais et en présence de chélateurs et d'antioxydants[19].
L'aniline réagit avec les iodures d'alkyle en formant des amines secondaires ou tertiaires. L'acide chromique permet de la transformer en quinone. Elle réagit avec les ions chlorate en présence de sels métalliques (notamment de vanadium) en formant du noir d'aniline. Elle réagit avec l'acide chlorhydrique et le chlorate de potassium en formant du chloranile. L'oxydation par le permanganate de potassium produit du nitrobenzène en milieu neutre, de l'azobenzène, de l'ammoniaque et de l'acide oxalique en milieu basique, et du noir d'aniline en milieu acide. Elle réagit avec l'acide hypochloreux en formant du para-amino phénol et du para-amino diphénylamine.
Tout comme le benzène ou le phénol, l'aniline est réactive par substitution électrophile aromatique. Par exemple, elle peut subir une sulfonation pour former de l'acide sulfonique, qui peut être transformé en sulfonamides (médicaments très utilisés au début du XXe siècle comme antiseptique).
L'aniline réagit avec l'acide nitreux pour former des sels de diazonium. Par leur intermédiaire, le groupe amino peut être transformé simplement en groupe hydroxy, cyano ou halogénure.
Usages
.jpg.webp)
Son intérêt commercial originel vient de sa capacité à teindre avec un bon rendement. La découverte de la mauvéine par William Henry Perkin en 1858 a initié la découverte d'un grand nombre de colorants qui se comptèrent bientôt par centaines. Du troisième quart du XIXe siècle aux deux premiers du XXe siècle, l'expression « couleurs d'aniline » désignait par extension toutes les matières colorantes organiques, et des encres liquides qu'elles coloraient (PRV1).
En sus des teintures, l'aniline a été le produit de départ de la synthèse d'un grand nombre de médicaments.
Jusqu'à l'arrivée du stylo à bille, les crayons à l'aniline connurent un grand succès. Malgré la toxicité, on en mouillait la pointe du bout de la langue pour en obtenir un trait bleu intense et indélébile. L'encre à aniline était également utilisée dans le cadre de la reproduction mécanique de documents (procédé dit d'hectographie).
À l'heure actuelle, l'utilisation la plus importante de l'aniline concerne la fabrication du 4,4'-MDI, qui utilise environ 85 % de l'aniline produite. Parmi les autres utilisations, on peut citer la fabrication chimique de caoutchouc (9 %), d'herbicides (2 %) et de pigments ou agents colorants (2 %).
Test de Schaeffer
L'aniline est utilisée comme réactif chimique dans la détermination de certains champignons. Le test consiste à tracer une ligne avec de l'acide nitrique concentré (68 %) puis une ligne perpendiculaire avec de l'aniline. Le test est positif si une coloration orange apparaît au croisement[20].
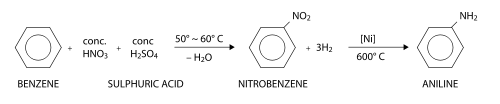
Fabrication
L'aniline peut être fabriquée à partir du benzène en deux étapes. Au cours de la première étape, le benzène subit une nitration (substitution électrophile aromatique utilisant de l'acide nitrique) pour former du nitrobenzène. Au cours de la seconde étape, le nitrobenzène est réduit pour former l'aniline. Une grande variété de réactifs réducteurs peuvent être employés au cours de cette seconde étape, dont notamment du dihydrogène (en présence d'un catalyseur), du sulfure d'hydrogène, ou des métaux comme le fer, le zinc ou l'étain.
Toxicité et sécurité
L'aniline, très toxique, doit être manipulée avec précaution. La classification CEE (étiquetage réglementaire des substances et préparations dangereuses) l'a classée comme « très toxique pour les organismes aquatiques, et dangereuse pour l'environnement ».
Une exposition à des concentrations élevées peut être mortelle. Elle peut être absorbée par inhalation, ingestion et contact avec la peau, y compris sous forme de vapeur. Chauffée à plus de 190 °C, elle se décompose en produisant des fumées toxiques (contenant notamment de l'ammoniaque).
Certains organismes classent l'aniline dans la liste des substances cancérigènes. Cependant, l'Agence internationale de recherche sur le cancer la classe sur la liste 3 (« classification impossible quant au pouvoir cancérogène pour les humains »), les données disponibles étant contradictoires et trop peu nombreuses.
La dose létale 50 a été évaluée à 250 mg kg−1 par voie orale chez le rat[21].
La valeur limite d'exposition professionnelle est fixée en France à 2 ppm, soit 10 mg m−3.
Controverse
Des études épidémiologiques[Lesquelles ?] ont lié des mélanges d'huile contenant de l'huile de colza dénaturée et de l'aniline avec l'épidémie de « syndrome de l'huile toxique » qui a touché l'Espagne en 1981 et fait environ 20 000 malades graves, entraînant 12 000 hospitalisations et plus de 350 décès. L'étiologie de ce syndrome demeure inconnue.
Voir aussi
Bibliographie
- Jean Petit, Jacques Roire et Henri Valot, Encyclopédie de la peinture : formuler, fabriquer, appliquer, t. 1, Puteaux, EREC, , p. 195 « Aniline (couleurs d'…) ».
Articles connexes
Liens externes
- Fiche internationale de sécurité
- Fiche toxicologique, INRS
- (en) « Aniline », dans Encyclopædia Britannica, 1911 [
 (en) Lire en ligne sur Wikisource].
(en) Lire en ligne sur Wikisource].
Notes et références
- ANILINE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Aniline », sur nih.gov (consulté le ).
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1, BNF 41361395), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 978-0-471-98369-9, LCCN 98018212).
- « Aniline » dans la base de données Hazardous Substances Data Bank, consulté le 16 juillet 2012
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5, présentation en ligne), p. 294.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9, LCCN 96051648), p. 2-50.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic compounds C5 to C7, vol. 2, Huston, Texas, Gulf Pub., , 400 p. (ISBN 978-0-88415-858-5, LCCN 96036328).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- « Aniline », sur reciprocalnet.org (consulté le ).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008, 16 décembre 2008.
- « Aniline » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le ).
- Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada.
- « Aniline », sur hazmap.nlm.nih.gov (consulté le ).
- Philip Ball (trad. Jacques Bonnet), Histoire vivante des couleurs : 5000 ans de peinture racontée par les pigments [« Bright Earth: The Invention of Colour »], Paris, Hazan, , p. 305sq. ; Rodolphe Radau, « Les nouvelles couleurs dérivées du goudron de houille », Revue des Deux Mondes, , p. 899 (Page:Revue des Deux Mondes - 1874 - tome 4.djvu/905).
- « Amines et dérivés », sur pharmtox.free.fr (consulté le ).
- « Aniline et acide nitrique pour la réaction de Schaeffer » [PDF], sur Cercle des mycologues du Luxembourg belge.
- D'après « Fiches de sécurité », sur Sciences Physiques et Chimiques, Académie de Nancy-Metz.
- Portail de la chimie