Anisaldéhyde
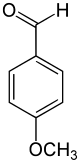
L'anisaldéhyde, ou plus précisément le 4-anisaldéhyde (ou encore paraanisaldéhyde, aldéhyde anisique, 4-méthoxybenzaldéhyde, paraméthoxybenzaldéhyde) est un composé organique de formule CH3OC6H4COH. C'est l'isomère para du méthoxybenzaldéhyde, composé constitué d'un noyau benzénique auquel sont attachés un groupe méthoxyle et un groupe aldéhyde, et sans doute l'isomère le plus courant des trois. C'est un liquide jaunâtre relativement peu soluble dans l'eau, avec une forte odeur caractéristique d'anis, douce et florale. D'origine naturelle ou synthétique, il est souvent utilisé comme parfum ou arôme. Sa structure est relativement proche de celle de l'anéthol et de celle de la vanilline.
| Anisaldéhyde | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | 4-méthoxybenzaldéhyde |
| Synonymes |
4-anisaldéhyde, paraanisaldéhyde, p-anisaldéhyde, aldéhyde anisique |
| No CAS | |
| No ECHA | 100.004.185 |
| No RTECS | BZ2625000 |
| PubChem | 31244 |
| SMILES | |
| InChI | |
| Apparence | liquide jaunâtre à l'odeur caractéristique[1] |
| Propriétés chimiques | |
| Formule | C8H8O2 [Isomères] |
| Masse molaire[2] | 136,147 9 ± 0,007 6 g/mol C 70,57 %, H 5,92 %, O 23,5 %, |
| Propriétés physiques | |
| T° fusion | 0 à 2 °C[1] |
| T° ébullition | 247 à 249 °C[1] |
| Solubilité | 2 g·L-1 (eau, (20 °C)[réf. souhaitée] |
| Masse volumique | 1,12 g·cm-3 (25 °C)[1] |
| T° d'auto-inflammation | 220 °C[1] |
| Point d’éclair | 116 °C (coupelle fermée)[1],[3] |
| Limites d’explosivité dans l’air | 1,4 - 5,3 vol.%[1] |
| Pression de vapeur saturante | <1 hPa (20 °C) 77 hPa (160 °C)[1] |
| Viscosité dynamique | 4,2 mPa·s[1] |
| Écotoxicologie | |
| DL50 | 3 210 mg·kg-1 (rat, oral)[1] > 5 000 mg·kg-1 (lapin, dermique)[1] |
| LogP | 1,65[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Occurrence naturelle
L'anisaldéhyde est présent dans les diverses variétés d'anis et de fenouil, ainsi que dans des huiles essentielles. Il est produit par les plantes via la voie métabolique de l'acide shikimique.
Synthèse
L'anisaldéhyde est synthétisé commercialement par oxydation du 4-méthoxytoluène en utilisant du dioxyde de manganèse pour convertir le groupe méthyle en groupe aldéhyde. Il peut également être obtenu à partir de l'anéthol, un composé à la structure et au parfum proches, utilisé notamment dans la production de boissons alcoolisées anisées (pastis, ouzo, absinthe, etc.) par clivage oxydatif du groupe alcène[4], par exemple par l'acide nitrique ou l'acide chromique. L'anisaldéhyde peut encore être préparé par réaction de Vilsmeier-Haack à partir de l'anisole.
Utilisations
L'anisaldéhyde est largement utilisé en parfumerie et comme arôme[4]. C'est également un intermédiaire dans la synthèse de composés utilisés en parfumerie et dans l'industrie pharmaceutique.
L'anisaldéhyde est également utilisé en chromatographie sur couche mince[5],[6],[7].
Réactions
Il est possible de réduire ou d'oxyder la fonction aldéhyde de l'anisaldéhyde, donnant respectivement l'alcool anisique (alcool 4-méthoxybenzylique) et l'acide anisique (acide 4-méthoxybenzoïque).
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « 4-Anisaldehyde » (voir la liste des auteurs) et en allemand « Anisaldehyd » (voir la liste des auteurs).
- Entrée « 4-Methoxybenzaldehyde » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 avril 2019 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé p-Anisaldehyde, consultée le 2 avril 2019.
- (en) Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe et Horst Surburg, « Flavors and Fragrances », dans Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH (DOI 10.1002/14356007.a11_141)
- Stains for Developing TLC Plates
- (de) Egon Stahl et Werner Schild, Isolierung und Charakterisierung von Naturstoffen, Stuttgart/New York, Gustav Fischer Verlag, , 180 p. (ISBN 978-3-437-30511-5), p. 173
- (de) Europäisches Arzneibuch, vol. 1, Stuttgart/Eschborn, Deutscher Apotheker Verlag/Govi-Verlag – Pharmazeutischer Verlag GmbH, (ISBN 978-3-7692-2947-9), p. 384
- Portail de la chimie