Micro-organisme sulfato-réducteur
Les micro-organismes sulfato-réducteurs (MSR) ou réducteurs de sulfate, encore appelés procaryotes sulfato-réducteurs (PSR) sont un groupe de microorganismes comprenant les bactéries sulfato-réductrices (BSR) et les archées sulfato-réducteurs (ASR). Ces deux sous-groupes peuvent effectuer leur respiration anaérobie en utilisant le sulfate (SO42−) comme accepteur d'électron final, en le réduisant en sulfure d'hydrogène (H2S)[1],[2]. Par conséquent, ces micro-organismes sulfidogènes "respirent" du sulfate plutôt que de l'oxygène moléculaire (O2), qui est l'accepteur d'électrons final réduit en eau (H2O) dans la respiration aérobie.
La plupart des micro-organismes réducteurs de sulfate peuvent également réduire certains autres composés inorganiques oxydés du soufre, tels que le sulfite (SO32−), le dithionite (S2O42−), le thiosulfate (S2O32−), le trithionate (S3O62−), le tétrathionate (S4O62−), le soufre élémentaire (S8) et les polysulfures (Sn2−). Selon le contexte, l'appellation "micro-organismes réducteurs de sulfate" peut être utilisée dans un sens plus large (incluant toutes les espèces qui peuvent réduire l'un de ces composés sulfurés) ou dans un sens plus étroit (incluant uniquement les espèces qui réduisent le sulfate, et excluant les réducteurs stricts de thiosulfate et de soufre, par exemple).
Les micro-organismes réducteurs de sulfate existent depuis 3,5 milliards d'années et sont considérés comme l'une des plus anciennes formes de micro-organismes, contribuant au cycle du soufre depuis peu après l'apparition de la vie sur Terre[3].
De nombreux organismes réduisent de petites quantités de sulfates afin de synthétiser des composants cellulaires contenant du soufre dont ils ont besoin : c'est ce qu'on appelle la réduction des sulfates assimilables. En revanche, les micro-organismes réducteurs de sulfate considérés ici réduisent le sulfate en grandes quantités pour obtenir de l'énergie et expulser le sulfure résultant sous forme de déchet : c'est ce qu'on appelle la réduction dissimilatoire du sulfate[4]. Ils utilisent le sulfate comme accepteur terminal d'électrons dans leur chaîne de transport d'électrons[5]. La plupart d'entre eux sont anaérobies ; cependant, il existe des exemples de micro-organismes réducteurs de sulfate qui tolèrent l'oxygène, et certains d'entre eux peuvent même pratiquer la respiration aérobie[6]. On n'observe en revanche aucune croissance lorsque l'oxygène est utilisé comme seul accepteur d'électrons[7]. En outre, il existe des micro-organismes réducteurs de sulfate qui peuvent également réduire d'autres accepteurs d'électrons, tels que le fumarate, le nitrate (NO3−), le nitrite (NO2−), le fer ferrique (Fe3+) et le diméthylsulfoxyde (DMS)[1],[8].
En termes de donneur d'électrons, ce groupe comprend à la fois des organotrophes et des lithotrophes. Les organotrophes oxydent les composés organiques, tels que les hydrates de carbone, les acides organiques (formate, lactate, acétate, propionate et butyrate par exemple), les alcools (méthanol et éthanol), les hydrocarbures aliphatiques (dont le méthane) et les hydrocarbures aromatiques (benzène, toluène, éthylbenzène et xylène). Les lithotrophes oxydent l'hydrogène moléculaire (H2), pour lequel ils entrent en compétition avec les méthanogènes et les acétogènes dans des conditions anaérobies[9]. Certains micro-organismes réducteurs de sulfate peuvent utiliser directement le fer métallique (Fe) comme donneur d'électrons, l'oxydant en fer ferreux (Fe2+)[10].
Importance écologique et biomarqueurs
Le sulfate est largement présent dans l'eau de mer, les sédiments ou les eaux riches en matières organiques en décomposition[5]. On le trouve également dans des environnements plus extrêmes tels que les cheminées hydrothermales, les sites de drainage des mines d'acide, les champs pétrolifères et le sous-sol profond[1], y compris dans la plus ancienne nappe phréatique isolée du monde[11],[12]. Les micro-organismes réducteurs de sulfate sont courants dans les environnements anaérobies où ils contribuent à la dégradation des matières organiques[13]. Dans ces environnements anaérobies, les bactéries fermentrices extraient l'énergie des grosses molécules organiques ; les petits composés qui en résultent, tels que les acides organiques et les alcools, sont ensuite oxydés par les acétogènes et les méthanogènes et par les micro-organismes réducteurs de sulfate concurrents[5].
Le sulfure d'hydrogène, toxique, est un déchet provenant des micro-organismes sulfato-réducteurs ; son odeur d'œuf pourri est souvent un marqueur de la présence de micro-organismes sulfato-réducteurs dans la nature[13]. Les micro-organismes sulfato-réducteurs sont responsables des odeurs sulfureuses des marais salants et des vasières. Une grande partie du sulfure d'hydrogène réagit avec les ions métalliques présents dans l'eau pour produire des sulfures métalliques. Ces sulfures métalliques, tels que le sulfure ferreux (FeS), sont insolubles et souvent noirs ou bruns, ce qui donne aux boues une couleur foncée[2].
Lors de l'extinction du Permien-Trias (il y a 250 millions d'années), un grave épisode anoxique semble s'être produit, au cours duquel ces formes de bactéries sont devenues la force dominante des écosystèmes océaniques, produisant de grandes quantités de sulfure d'hydrogène[14].
Les bactéries réductrices de sulfate génèrent également du méthylmercure neurotoxique comme sous-produit de leur métabolisme, par méthylation du mercure inorganique présent dans leur environnement. Elles sont connues pour être la source dominante de cette forme bioaccumulative de mercure dans les systèmes aquatiques[15].
Utilisations
Certains micro-organismes réducteurs de sulfate peuvent réduire les hydrocarbures, et cette aptitude a mené à les utiliser pour dépolluer des sols contaminés. Leur utilisation a également été proposée pour d'autres types de contaminations[3].
Les micro-organismes sulfato-réducteurs sont considérés comme un moyen possible de traiter les eaux de mine acides produites par d'autres microorganismes[16].
Problèmes causés par les micro-organismes sulfato-réducteurs
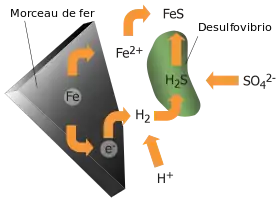
En ingénierie, les micro-organismes réducteurs de sulfate peuvent créer des problèmes lorsque des structures métalliques sont exposées à de l'eau contenant du sulfate. En effet, l'interaction entre l'eau et le métal crée une couche d'hydrogène moléculaire sur la surface du métal ; les micro-organismes réducteurs de sulfate oxydent alors l'hydrogène tout en créant du sulfure d'hydrogène, ce qui contribue à la corrosion. Cette biocorrosion s'observe également sur les palplanches et les réservoirs d'hydrocarbures.
Le sulfure d'hydrogène provenant des micro-organismes réducteurs de sulfate joue également un rôle dans la corrosion biogènique du béton par les sulfures. Il est également présent dans le pétrole brut acide[3].
Certains microorganismes sulfato-réducteurs jouent un rôle dans l'oxydation anaérobie du méthane via la réaction suivante[3] :
Une fraction importante du méthane formé par les méthanogènes sous les fonds marins est oxydée par des micro-organismes réducteurs de sulfate dans la zone de transition séparant la méthanogénèse de l'activité de réduction du sulfate dans les sédiments. Ce processus est également considéré comme un puits majeur de sulfate (c'est-à-dire un compartiment qui stocke du sulfate) dans les sédiments marins.
Dans la fracturation hydraulique, les fluides sont utilisés pour fracturer les formations de schiste afin de récupérer le méthane (gaz de schiste) et les hydrocarbures. Des composés biocides sont souvent ajoutés à l'eau pour inhiber l'activité microbienne des microorganismes sulfato-réducteurs, afin, entre autres, d'éviter l'oxydation anaérobie du méthane et la génération de sulfure d'hydrogène, ce qui permet finalement de minimiser les pertes de production potentielles.
Biochimie
Avant que le sulfate puisse être utilisé comme accepteur d'électrons, il doit être activé. Cela est fait par l'enzyme ATP-sulfurylase, qui utilise l'ATP et le sulfate pour créer l'adénosine 5'-phosphosulfate (APS). L'APS est ensuite réduite en sulfite et en AMP. Le sulfite est ensuite encore réduit en sulfure, tandis que l'AMP est transformée en ADP en utilisant une autre molécule d'ATP. Le processus global implique donc un investissement de deux molécules du vecteur énergétique ATP, qui devront être récupérées de la réduction[1].

Le gène dsrAB, codant l'enzyme (bi)sulfite réductase dissimilatoire, qui catalyse la dernière étape de la réduction dissimilatoire du sulfate, est le gène fonctionnel le plus utilisé comme marqueur moléculaire pour détecter la présence de micro-organismes sulfato-réducteurs[17].
Phylogénie
Les micro-organismes réducteurs de sulfate ont été traités en tant que groupe phénotypique, avec les autres bactéries réductrices de soufre, à des fins d'identification. On les trouve dans plusieurs lignées phylogénétiques différentes[18]. En 2009, on connaissait 60 genres contenant 220 espèces de bactéries réductrices de sulfate[3].
Chez les Deltaprotéobactéries, les ordres de bactéries réductrices de sulfate comprennent les Desulfobacterales, les Desulfovibrionales et les Syntrophobacterales. Cela représente le plus grand groupe de bactéries réductrices de sulfate, soit environ 23 genres[1].
Le deuxième groupe de bactéries réductrices de sulfate le plus important se trouve parmi les Firmicutes, y compris les genres Desulfotomaculum, Desulfosporomusa et Desulfosporosinus.
Dans la division des Nitrospirae, on trouve les espèces Thermodesulfovibrio réductrices de sulfate.
Deux autres groupes comprenant des bactéries thermophiles réductrices de sulfate ont leur propre phylum, les Thermodesulfobactéries et Thermodesulfobium (qui est le seul genre connu du phylum qui porte donc le même nom).
Il existe également trois genres connus d'archées sulfato-réducteurs : Archaeoglobus, Thermocladium et Caldivirga. On les trouve dans les cheminées hydrothermales, les gisements de pétrole et les sources chaudes.
En juillet 2019, une étude scientifique de la mine Kidd au Canada a découvert des organismes qui vivent à 2400 m sous la surface et qui respirent du soufre pour leur métabolisme. ces organismes sont également remarquables car ils consomment régulièrement des roches comme la pyrite qui constitue ainsi une source de nourriture[11],[19],[20]. Cette découverte a été faite dans de l'eau qui s'est avérée être la plus ancienne connue sur Terre[21].
Voir aussi
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sulfate-reducing microorganisms » (voir la liste des auteurs).
Références
- Gerard Muyzer et Alfons J. M. Stams, « The ecology and biotechnology of sulphate-reducing bacteria », Nature Reviews. Microbiology, vol. 6, no 6, , p. 441–454 (ISSN 1740-1534, PMID 18461075, DOI 10.1038/nrmicro1892, lire en ligne, consulté le )
- (en) Ernst-Detlef Schulze, Biodiversity and Ecosystem Function: With 22 Tables, Springer Science & Business Media, (ISBN 978-3-540-58103-1, lire en ligne)
- Larry L. Barton et Guy D. Fauque, « Biochemistry, physiology and biotechnology of sulfate-reducing bacteria », Advances in Applied Microbiology, vol. 68, , p. 41–98 (ISSN 0065-2164, PMID 19426853, DOI 10.1016/S0065-2164(09)01202-7, lire en ligne, consulté le )
- Christian Rückert, « Sulfate reduction in microorganisms-recent advances and biotechnological applications », Current Opinion in Microbiology, vol. 33, , p. 140–146 (ISSN 1879-0364, PMID 27461928, DOI 10.1016/j.mib.2016.07.007, lire en ligne, consulté le )
- (en) Larry Barton, Sulfate-Reducing Bacteria, Springer Science & Business Media, (ISBN 978-0-306-44857-7, lire en ligne)
- Kasper U. Kjeldsen, Catherine Joulian et Kjeld Ingvorsen, « Oxygen tolerance of sulfate-reducing bacteria in activated sludge », Environmental Science & Technology, vol. 38, no 7, , p. 2038–2043 (ISSN 0013-936X, PMID 15112804, DOI 10.1021/es034777e, lire en ligne, consulté le )
- (en) Simone Dannenberg, Michael Kroder, Waltraud Dilling et Heribert Cypionka, « Oxidation of H2, organic compounds and inorganic sulfur compounds coupled to reduction of O2 or nitrate by sulfate-reducing bacteria », Archives of Microbiology, vol. 158, no 2, , p. 93–99 (ISSN 1432-072X, DOI 10.1007/BF00245211, lire en ligne, consulté le )
- Caroline M. Plugge, Weiwen Zhang, Johannes C. M. Scholten et Alfons J. M. Stams, « Metabolic flexibility of sulfate-reducing bacteria », Frontiers in Microbiology, vol. 2, , p. 81 (ISSN 1664-302X, PMID 21734907, PMCID 3119409, DOI 10.3389/fmicb.2011.00081, lire en ligne, consulté le )
- Warounsak Liamleam et Ajit P. Annachhatre, « Electron donors for biological sulfate reduction », Biotechnology Advances, vol. 25, no 5, , p. 452–463 (ISSN 0734-9750, PMID 17572039, DOI 10.1016/j.biotechadv.2007.05.002, lire en ligne, consulté le )
- Souichiro Kato, « Microbial extracellular electron transfer and its relevance to iron corrosion », Microbial Biotechnology, vol. 9, no 2, , p. 141–148 (ISSN 1751-7915, PMID 26863985, PMCID 4767289, DOI 10.1111/1751-7915.12340, lire en ligne, consulté le )
- Garnet S. Lollar, Oliver Warr, Jon Telling et Magdalena R. Osburn, « ‘Follow the Water’: Hydrogeochemical Constraints on Microbial Investigations 2.4 km Below Surface at the Kidd Creek Deep Fluid and Deep Life Observatory », Geomicrobiology Journal, vol. 36, no 10, , p. 859–872 (ISSN 0149-0451, DOI 10.1080/01490451.2019.1641770, lire en ligne, consulté le )
- (en) « World’s Oldest Groundwater Supports Life Through Water-Rock Chemistry | Deep Carbon Observatory », sur deepcarbon.net, (consulté le )
- Betsey Dexter Dyer, A field guide to bacteria, Ithaca, N.Y. : Cornell University Press, (lire en ligne)
- Peter D. Ward, « IMPACT from the DEEP », Scientific American, vol. 295, no 4, , p. 64–71 (ISSN 0036-8733, lire en ligne, consulté le )
- G. C. Compeau et R. Bartha, « Sulfate-reducing bacteria: principal methylators of mercury in anoxic estuarine sediment », Applied and Environmental Microbiology, vol. 50, no 2, , p. 498–502 (ISSN 0099-2240, PMID 16346866, lire en ligne, consulté le )
- Ayansina S. Ayangbenro, Oluwaseyi S. Olanrewaju et Olubukola O. Babalola, « Sulfate-Reducing Bacteria as an Effective Tool for Sustainable Acid Mine Bioremediation », Frontiers in Microbiology, vol. 9, , p. 1986 (ISSN 1664-302X, PMID 30186280, PMCID 6113391, DOI 10.3389/fmicb.2018.01986, lire en ligne, consulté le )
- Albert Leopold Müller, Kasper Urup Kjeldsen, Thomas Rattei et Michael Pester, « Phylogenetic and environmental diversity of DsrAB-type dissimilatory (bi)sulfite reductases », The ISME journal, vol. 9, no 5, , p. 1152–1165 (ISSN 1751-7370, PMID 25343514, PMCID 4351914, DOI 10.1038/ismej.2014.208, lire en ligne, consulté le )
- Norbert Pfennig, Friedrich Widdel et Hans G. Trüper, « The Dissimilatory Sulfate-Reducing Bacteria », dans The Prokaryotes, Springer Berlin Heidelberg, (ISBN 978-3-662-13189-3, lire en ligne), p. 926–940
- (en) « World’s Oldest Groundwater Supports Life Through Water-Rock Chemistry | Deep Carbon Observatory », sur deepcarbon.net (consulté le )
- (en) « Strange life forms found deep in a mine point to vast 'underground Galapagos' », sur NBC News (consulté le )
- (en) « Oldest Water on Earth Found Deep Within the Canadian Shield », sur The Science Explorer (consulté le )
Lectures complémentaires
- J. Philibert, A. Vignes, Y. Bréchet, P. Combrade, Métallurgie, du minerai au matériau, Dunod, , p. 960
- (en) Lollar et al., 2019 : "Suivez l'eau" : Contraintes hydrogéochimiques sur les recherches microbiennes à 2,4 km sous la surface à l'Observatoire des Fluides et de la Vie en Profondeur de Kidd Creek (Geomicrobiology Journal 36(10), 859-872)
- (en) Holland et al., 2013 : "Fluides de fracture profonde isolés dans la croûte depuis l'ère précambrienne" (Nature 497(7449), 357-360)
- (en) Li et al., 2016) : "Le fractionnement indépendant de la masse du soufre dans les eaux de fractures souterraines indique un cycle du soufre de longue durée dans les roches précambriennes" (Nature Communications 7(1), 1-9)
- (en) "La mystérieuse 'biosphère profonde' de la Terre pourrait abriter des millions d'espèces inconnues" par Brandon Specktor, Live Science (2018), sur le site nbcnews.com
Articles connexes
- Portail de la microbiologie