Batterie à flux redox
Une batterie à flux redox, batterie redox flow ou pile d'oxydoréduction[1] est un type de batterie d'accumulateurs, dans lequel l'énergie est stockée dans deux solutions électrolytiques, pompées à travers la cellule électrochimique et stockées dans des réservoirs. L'innovation principale de ces système en comparaison des batteries classiques réside dans le découplage entre la capacité énergétique et la puissance de la pile. Ces dispositifs sont en revanche assez encombrants (aussi bien en masse qu'en volume) et sont donc plutôt destinés à des applications stationnaires.
Principe
Les batteries à flux redox sont un type d'accumulateurs dans lequel l'énergie est stockée dans un ou plusieurs électrolytes contenant des couples oxydant-réducteur particuliers. Elles sont composées d'une cellule électrochimique contenant deux électrodes séparées par un séparateur (le plus souvent une membrane échangeuse de protons). Particularité de ces dispositifs, les électrolytes sont stockées dans des cuves, reliées à la cellule grâce à un système de pompage. Les électrolytes sont la plupart du temps aqueux.
Les limites de ces batteries sont la faible densité énergétique. Elle dépend en effet de la solubilité des espèces réactives, qui est relativement faible. Une trop forte concentration peut entraîner des précipitations et détériorer le fonctionnement.
Principaux types employés
Batteries « tout vanadium »
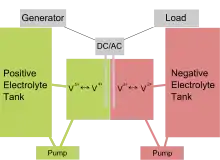
La batterie « tout vanadium » est la batterie redox flow la plus utilisée actuellement. Développée en 1985 par la chercheuse Maria-Skyllas-Kazacos à l'université de Nouvelle-Galle du sud[2], elle utilise les couples d'oxydoréduction et . Les réactions ayant lieu de chaque côté sont les suivantes :
- demi-équation dans l'anolyte :
- demi-équation dans le catholyte :
- équation-bilan :
Cette batterie délivre une tension de 1,26V[3] et présente de nombreux avantages bien que le coût et la disponibilité de la matière première reste un frein certain.
Batteries Zn-Br
D'autres batteries utilisées à l'échelle industrielle emploient les couples et . Les réactions ayant lieu de chaque côté sont les suivantes[4] :
- demi-équation dans l'anolyte :
- demi-équation dans le catholyte :
- équation-bilan :
Dans ce dispositif, seul un seul réservoir est nécessaire, augmentant ainsi la densité énergétique[3]. En effet le zinc, lors de la décharge est déposé à l'état solide sur l'électrode. Malgré cet avantage certain, des inquiétudes s'élève quant au danger sanitaire et environnemental que ces solutions peuvent engendrer[5].
Batteries Fe-Cr
Les batteries fer-chrome sont les premières à avoir été utilisées. Développées par la Nasa dans les années 1980[6], elles mettent en jeu les réactions suivantes :
- demi-équation dans l'anolyte :
- demi-équation dans le catholyte :
- équation-bilan :
Cette pile délivre une tension de 1,18 V[3]. La réaction oxydoréductrice du couple Fe(II)/Fe(III) est très rapide et réversible, tandis que celle du couple Cr(II)/Cr(III) nécessite une catalyse. La température de fonctionnement avoisine les 65 °C et cette chaleur redirigée de façon à favoriser thermodynamiquement les réactions, cela cause une perte d'énergie (dissipation) conséquente et une architecture compliquée. Le bas potentiel électrochimique du chrome, enfin, entraine des réactions parasite avec le solvant (production de H2).
Composants
Matériaux d'électrode
Les matériaux d'électrodes employés dans les batteries à flux redox sont relativement similaires à ceux des autres dispositifs électrochimiques. Le critère motivant le choix est souvent la surface de contact importante avec les électrolytes. On retrouve le graphite[7] en place prépondérante mais aussi d'autres nanostructurations du carbone comme des microfibres[8], des nanotubes[9] ou des feuillets de graphène[10]. D'autres types d'électrodes existent aussi de manière plus marginale, telles les grilles et mousses métalliques[11].
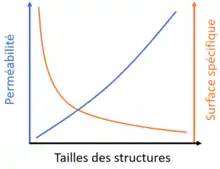
Outre la composition et la structure, plusieurs paramètres sont à prendre en compte dans le développement des électrodes[12]. Ainsi la taille des structures est assez sensible, un compromis est nécessaire entre une importante surface d'échange et une bonne perméabilité à l'électrolyte. La fonctionnalisation des surfaces par des groupes (sulfonation) permet l'augmentation de la mouillabilité[13],[14] et une électrocatalyse par des nanotubes de carbone[15] ou des nanoparticules métalliques est souvent nécessaire[16].
Membranes séparatrices
Les membranes séparatrices, ou séparateurs, sont un élément essentiel de toute batterie. Leur rôle dans la batterie à flux redox est l'échange de proton entre les deux compartiments tout en bloquant le transfert d'électron et d'ion. La membrane la plus utilisée reste le nafion, cependant, comme pour les piles à combustibles, son coût élevé pousse à la recherche d'alternatives[17].
Avantages et inconvénients
Points positifs
- Modularité : ces systèmes sont de grande taille et non-scellés. La maintenance et le remplacement de certaines pièces sont donc très aisées. Chaque composant peut être modifié à loisir, pour coller de près au cahier des charges.
- Coût : si l'investissement initial peut sembler important et peu avantageux comparé à des accumulateurs plus classiques, les économies d'échelles réalisées par la suite sont très importante. Il suffit, pour augmenter la capacité de la batterie, de changer les réservoirs pour d'autres de plus grande taille.
- Recharge instantanée : en cas de besoin, la batterie peut être rechargée instantanément en remplissant les réservoirs avec de l'électrolyte « frais ».
Points négatifs
- Tension de fonctionnement relativement faible[18] : l'usage d'électrolyte aqueux limite la fenêtre de potentiel utilisable.
- Faible capacité spécifique : il s'agît d'un stockage encombrant et volumineux.
- Pompes nécessaires : un dispositif de pompage est nécessaire pour faire circuler les électrolytes. Cela entraine une consommation d'électricité et une baisse du rendement énergétique.
Innovations dans le domaine
Usage des liquides ioniques
Les liquides ioniques sont des sels liquide à température ambiante. L'importante solubilité des sels métalliques dans ces milieux et leur large fenêtre électrochimique en font des candidats idéaux pour des électrolyte de batterie à flux[19],[20]. Certains chercheurs ont ainsi réussi à multiplier la concentration en sel de vanadium par 2,5 améliorant grandement la densité énergétique du dispositif.
Electrolyte semi solide
Afin d'augmenter la densité énergétique de ces batteries, des électrolytes semi solides ont été développés. Ils sont composés de particules de lithium en suspension, reliée électriquement les unes aux autres par des nanoparticules de carbone. Chacune de ces particules agît comme un simulacre de batterie lithium ion et permet ainsi de stocker dans l'électrolyte une quantité d'énergie dix fois supérieure aux applications plus classiques[21],[22].
Références
- (en) The International Flow Battery Forum, « The International Flow Battery Forum », sur flowbatteryforum.com, (consulté le ).
- (en) Maria Skyllas-Kazacos, Liuyue Cao, Michael Kazacos et Nadeem Kausar, « Vanadium Electrolyte Studies for the Vanadium Redox Battery—A Review », ChemSusChem, vol. 9, no 13, , p. 1521–1543 (ISSN 1864-564X, DOI 10.1002/cssc.201600102, lire en ligne, consulté le )
- (en) Wei Wang, Qingtao Luo, Bin Li et Xiaoliang Wei, « Recent Progress in Redox Flow Battery Research and Development », Advanced Functional Materials, vol. 23, no 8, , p. 970–986 (DOI 10.1002/adfm.201200694, lire en ligne, consulté le )
- « Zinc-Bromine Flow Battery - an overview », sur sciencedirect.com (consulté le ).
- (en) Krystyna Cedzynska, « Properties of modified electrolyte for zinc-bromine cells », Electrochimica Acta, vol. 40, no 8, , p. 971–976 (ISSN 0013-4686, DOI 10.1016/0013-4686(94)00372-8, lire en ligne, consulté le )
- (en) Norman H. Hagedcrn, « NASA Redox Storage System Development Project », U.S. Department of Energy Conservation and Renewable Energy Division of Energy Storage Systems, (lire en ligne
 [PDF]).
[PDF]). - (en) Wenyue Li, Jianguo Liu et Chuanwei Yan, « Graphite–graphite oxide composite electrode for vanadium redox flow battery », Electrochimica Acta, vol. 56, no 14, , p. 5290–5294 (ISSN 0013-4686, DOI 10.1016/j.electacta.2011.02.083, lire en ligne, consulté le )
- (en) J. Sun, M. C. Wu, X. Z. Fan et Y. H. Wan, « Aligned microfibers interweaved with highly porous carbon nanofibers: A Novel electrode for high-power vanadium redox flow batteries », Energy Storage Materials, vol. 43, , p. 30–41 (ISSN 2405-8297, DOI 10.1016/j.ensm.2021.08.034, lire en ligne, consulté le )
- (en) H. Q. Zhu, Y. M. Zhang, L. Yue et W. S. Li, « Graphite–carbon nanotube composite electrodes for all vanadium redox flow battery », Journal of Power Sources, selected papers from the: International Battery Materials Association 2007 Conference. In Memoriam of Juergen Besenhard, vol. 184, no 2, , p. 637–640 (ISSN 0378-7753, DOI 10.1016/j.jpowsour.2008.04.016, lire en ligne, consulté le )
- Sebastiano Bellani, Leyla Najafi, Mirko Prato et Reinier Oropesa-Nuñez, « Graphene-Based Electrodes in a Vanadium Redox Flow Battery Produced by Rapid Low-Pressure Combined Gas Plasma Treatments », Chemistry of Materials, vol. 33, no 11, , p. 4106–4121 (ISSN 0897-4756, PMID 34267420, PMCID PMC8274967, DOI 10.1021/acs.chemmater.1c00763, lire en ligne, consulté le )
- (en) Ping Zhao, Huamin Zhang, Hantao Zhou et Baolian Yi, « Nickel foam and carbon felt applications for sodium polysulfide/bromine redox flow battery electrodes », Electrochimica Acta, vol. 51, no 6, , p. 1091–1098 (ISSN 0013-4686, DOI 10.1016/j.electacta.2005.06.008, lire en ligne, consulté le )
- (en) Metin Gencten et Yucel Sahin, « A critical review on progress of the electrode materials of vanadium redox flow battery », International Journal of Energy Research, vol. 44, no 10, , p. 7903–7923 (ISSN 1099-114X, DOI 10.1002/er.5487, lire en ligne, consulté le )
- (en) Zhangxing He, Gang Cheng, Yingqiao Jiang et Ling Wang, « Sulfonated Carbon Nanotubes as Superior Catalysts towards V 3+ /V 2+ Redox Reaction for Vanadium Redox Flow Battery », Journal of The Electrochemical Society, vol. 165, no 5, , A932–A938 (ISSN 0013-4651 et 1945-7111, DOI 10.1149/2.0751805jes, lire en ligne, consulté le )
- (en) Zhangxing He, Yingqiao Jiang, Yuehua Li et Jing Zhu, « Carbon layer-exfoliated, wettability-enhanced, SO3H-functionalized carbon paper: A superior positive electrode for vanadium redox flow battery », Carbon, vol. 127, , p. 297–304 (ISSN 0008-6223, DOI 10.1016/j.carbon.2017.11.006, lire en ligne, consulté le )
- (en) Wenyue Li, Jianguo Liu et Chuanwei Yan, « Multi-walled carbon nanotubes used as an electrode reaction catalyst for VO2+/VO2+ for a vanadium redox flow battery », Carbon, vol. 49, no 11, , p. 3463–3470 (ISSN 0008-6223, DOI 10.1016/j.carbon.2011.04.045, lire en ligne, consulté le )
- (en) Rong-Hsin Huang, Chung-Hsing Sun, Tung-mo Tseng et Wen-kai Chao, « Investigation of Active Electrodes Modified with Platinum/Multiwalled Carbon Nanotube for Vanadium Redox Flow Battery », Journal of The Electrochemical Society, vol. 159, no 10, , A1579–A1586 (ISSN 0013-4651 et 1945-7111, DOI 10.1149/2.003210jes, lire en ligne, consulté le )
- (en) G. Hernandez-Flores, H.M. Poggi-Varaldo et O. Solorza-Feria, « Comparison of alternative membranes to replace
high cost Nafion ones in microbial fuel cells », International Journal of Hydrogen Energy, vol. 41, , p. 23354-23362, article no 48 (DOI https://doi.org/10.1016/j.ijhydene.2016.08.206, lire en ligne
 [PDF])
[PDF]) - « Table des potentiels standards »
 [PDF], sur lachimie.net (consulté le )
[PDF], sur lachimie.net (consulté le ) - (en) Georgios Nikiforidis, Amal Belhcen et Mérièm Anouti, « A highly concentrated vanadium protic ionic liquid electrolyte for the vanadium redox flow battery », Journal of Energy Chemistry, vol. 57, , p. 238–246 (ISSN 2095-4956, DOI 10.1016/j.jechem.2020.09.001, lire en ligne, consulté le )
- (en) M. A. Miller, J. S. Wainright et R. F. Savinell, « Communication—Iron Ionic Liquid Electrolytes for Redox Flow Battery Applications », Journal of The Electrochemical Society, vol. 163, no 3, , A578–A579 (ISSN 0013-4651 et 1945-7111, DOI 10.1149/2.0061605jes, lire en ligne, consulté le )
- (en) Zheng Li, Kyle C. Smith, Yajie Dong et Nir Baram, « Aqueous semi-solid flow cell: demonstration and analysis », Physical Chemistry Chemical Physics, vol. 15, no 38, , p. 15833–15839 (ISSN 1463-9084, DOI 10.1039/C3CP53428F, lire en ligne, consulté le )
- (en) Mihai Duduta, Bryan Ho, Vanessa C. Wood et Pimpa Limthongkul, « Semi-Solid Lithium Rechargeable Flow Battery », Advanced Energy Materials, vol. 1, no 4, , p. 511–516 (DOI 10.1002/aenm.201100152, lire en ligne, consulté le )
Voir aussi
Articles connexes
- Portail de l’énergie
- Portail de l’électricité et de l’électronique