Nafion
Le Nafion est le nom de marque d'un fluoropolymère copolymère à base de tétrafluoroéthylène sulfonaté découvert à la fin des années 1960 par Walther Grot chez DuPont. C'est le premier représentant des ionomères, classe de polymères synthétiques dont une fraction faible mais significative des unités monomère contient des groupes ioniques ou ionisables[3]. Les propriétés ioniques particulières du Nafion résultent de l'incorporation de groupes perfluorovinyle éther terminés par des groupes sulfonate sur une ossature en polytétrafluoroéthylène (PTFE)[4],[5],[6]. Le Nafion fait l'objet d'un intérêt particulier comme conducteur de protons pour membranes échangeuses de protons (PEM) destinées aux piles à combustible à PEM en raison de sa très bonne stabilité thermique et électrique.
| Nafion | |
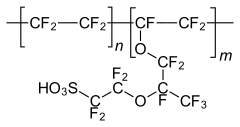
| |
| Unités monomère du Nafion. | |
| Identification | |
|---|---|
| Nom UICPA | 1,1,2,2-tétrafluoroéthène;acide 1,1,2,2-tétrafluoro-2-[1,1,1,2,3,3-hexafluoro-3-(1,2,2-trifluoroéthènoxy)propan-2-yl]oxyéthanesulfonique |
| No CAS | |
| PubChem | 61889 |
| ChEBI | 53682 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | pour C2F4–C7HF13O5S |
| Masse molaire[1] | 544,139 ± 0,014 g/mol C 19,87 %, H 0,19 %, F 59,35 %, O 14,7 %, S 5,89 %, |
| Précautions | |
| SGH[2] | |
 Attention |
|
| NFPA 704[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le fondement chimique des propriétés conductrices exceptionnelles du Nafion fait l'objet d'études approfondies[4]. La conductivité ionique du Nafion augmente avec son degré d'hydratation. L'exposition du Nafion à un environnement humidifié ou à de l'eau liquide accroît le nombre de molécules d'eau associées à chaque groupe acide sulfonique –SO3H. La nature hydrophile des groupes ioniques attire les molécules d'eau, qui tendent à solvater les groupes ioniques et en dissocier les protons labiles. Les protons dissociés « sautent » ensuite d'un site acide à l'autre par un mécanisme facilité par les molécules d'eau et les liaisons hydrogène[4]. Sous l'effet de l'hydratation, le Nafion forme des phases de taille nanométrique formant un réseau interconnecté de domaines hydrophiles qui permettent la circulation de l'eau et des cations tandis que les membranes ne conduisent pas les anions et les électrons. Le Nafion peut être produit sous différentes formes cationiques afin d'ajuster sa conductivité cationique.
Nomenclature
Le Nafion peut être produit aussi bien sous forme de résine en poudre que de copolymère. Il présente diverses configurations chimiques et donc plusieurs noms dans la nomenclature de l'IUPAC.
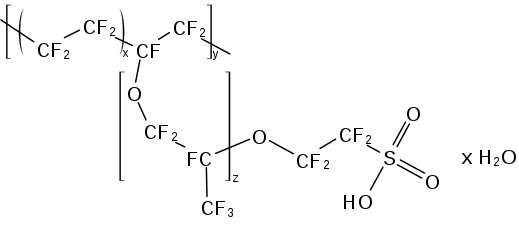 Structure générale du Nafion.
Structure générale du Nafion.
La masse moléculaire du Nafion est variable compte tenu de la variété de procédés pour le produire et de configurations en solution[5],[6]. La structure générale du Nafion, illustrée ci-dessus, souligne la variabilité de ce matériau. Ainsi, les unités monomère présentent des variations de chaîne entre les groupes éther, indiquées par l'indice z. Les méthodes conventionnelles de détermination de la masse moléculaire comme la diffusion de la lumière et la chromatographie par perméation de gel (en) ne sont pas applicables car le Nafion est insoluble ; la masse moléculaire du Nafion a cependant été estimée entre 100 et 1 000 kDa[5],[6].
Plutôt que la masse moléculaire, on utilise la masse équivalente (EW) et l'épaisseur du matériau pour décrire les membranes disponibles dans le commerce. La masse équivalente est le nombre de grammes de Nafion sec par mole de groupes d'acide sulfonique lorsque le matériau est sous forme acide[6]. Le Nafion 117 indique par exemple un Nafion avec une masse équivalente de 1 100 g et une épaisseur de 0,007 pouce.
Au lieu de la masse équivalente, les résines échangeuses d'ions sont généralement décrites en termes de capacité d'échange d'ions (IEC), qui s'exprime comme l'inverse de la masse équivalente, c'est-à-dire : IEC = 1 000 / EW.
Structure et morphologie
La morphologie des membranes en Nafion fait l'objet de recherches continues afin de mieux pouvoir contrôler leurs propriétés. La structure du Nafion conditionne ses propriétés par rapport à l'eau, à la stabilité de son hydratation à haute température, sa résistance électro-osmotique ainsi que sa stabilité thermique, mécanique et à l'oxydation. Plusieurs modèles pour décrire la morphologie du Nafion ont été proposés afin de rendre compte de ses propriétés particulières de transport des ions[4].
Le premier modèle, dit du réseau de clusters, ou du réseau de canaux, a été proposé en 1982 par Gierke et al.[7]. Il consiste en une distribution régulière de clusters d'ions sulfonate, également décrits comme des micelles inversées[6], avec un diamètre d'environ 4 nm maintenu dans un réseau de fluorocarbures continu. Des canaux d'environ 1 nm de diamètre interconnectent ces clusters, ce qui explique les propriétés de transport ionique de ces matériaux[5],[6],[8].
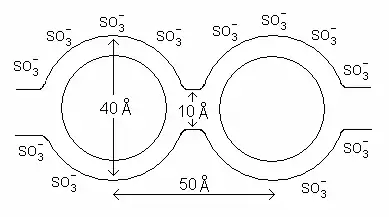 Modèle du réseau de clusters.
Modèle du réseau de clusters.
Il est difficile de déterminer la structure exacte du Nafion en raison de sa solubilité et de sa structure cristalline très variables en fonction de ses nombreux dérivés. Des modèles morphologiques avancés ont proposé un modèle cœur-coquille dans lequel le cœur riche en ions et entouré d'une coquille pauvre en ions, un modèle en bâtonnets dans lequel les groupes sulfoniques s'arrangent en bâtonnets cristallins, et un modèle sandwich dans lequel les polymères forment deux couches dont les groupes sulfoniques sont situés de part et d'autre d'une couche aqueuse au sein de laquelle se déroulent les phénomènes de transport des cations[6]. Ces modèles présentent tous un réseau de clusters ioniques mais diffèrent par la géométrie et la distribution de ces clusters. Bien qu'aucun de ces modèles ne soit révélé comme étant pleinement valide, certaines équipes ont montré que l'hydratation d'une membrane en Nafion fait passer ce matériau d'une morphologie en réseaux de clusters et une morphologie en bâtonnets[6].
Un modèle dit en canaux d'eau a été par la suite proposé[9] à partir de simulations par diffusion des rayons X aux petits angles et par résonance magnétique nucléaire à l'état solide (en). Dans ce modèle, les groupes fonctionnels d'acide sulfonique s'auto-organisent en réseaux de canaux d'eau hydrophiles, chacun d'environ 2,5 nm de diamètre, à travers lesquels des ions de petite taille peuvent être transportés facilement. L'ossature de polymères hydrophobes s'intercale entre ces canaux hydrophiles pour fournir la stabilité mécanique observée.
Production et propriétés
Le Nafion est produit par copolymérisation de tétrafluoroéthylène (TFE) — monomère du polytétrafluoroéthylène (PTFE) — et d'un dérivé de perfluoro(alkylvinyléther) avec un fluorure de sulfonyle –SO2F. Ce dernier réactif peut être obtenu par pyrolyse de ses oxydes ou acides carboyliques respectifs donnant la structure alkylée[10].
Le produit obtenu est un thermoplastique contenant des groupes –SO2F qui est extrudé sous forme de films. L'hydroxyde de sodium NaOH aqueux chaud convertit ces fluorures de sulfonyle en groupes sulfonate –SO3−Na+. Cette forme de Nafion, dite neutre ou saline, est finalement convertie en forme acide contenant des groupes acide sulfonique –SO3H. Il peut être moulé en films minces par chauffage en autoclave dans une solution aqueuse d'éthanol à 250 °C. Ce procédé, assez coûteux[11],[12], permet de produire du Nafion pour générer des films composites, revêtir des électrodes ou réparer des membranes endommagées[5].
La combinaison de l'ossature stable en PTFE avec les groupes acide sulfonique confèrent au Nafion ses caractéristiques :
- il est très conducteur pour les cations, ce qui le rend intéressant pour de nombreuses applications des membranes ;
- il est chimiquement résistant. D'après son fabricant, seuls les métaux alcalins peuvent dégrader le Nafion aux conditions normales de température et de pression ;
- l'ossature PTFE entrelacée avec les groupes sulfonate ioniques donne un Nafion une température d'exploitation élevée, atteignant par exemple 190 °C, cependant, de telles températures ne peuvent être atteintes avec le Nafion sous forme membranaire en raison de la perte d'eau et de résistance mécanique ;
- le Nafion est un catalyseur superacide avec un pKa d'environ −6[13]. De ce point de vue, le Nafion ressemble à l'acide triflique CF3SO3H, bien que le Nafion soit un acide plus faible d'environ trois ordres de grandeur ;
- il est très perméable à l'eau de manière sélective ;
- sa conductivité de protons, qui peut atteindre 0,2 S/cm, dépend de la température, du niveau d'hydratation, de l'historique thermique et des conditions de production du matériau[4],[14] ;
- la phase solide et la phase aqueuse du Nafion sont perméables aux gaz[15],[16], ce qui est un inconvénient pour les équipements de conversion d'énergie, comme les applications de photosynthèse artificielle, de piles à combustibles et d'électrolyse de l'eau.
Applications
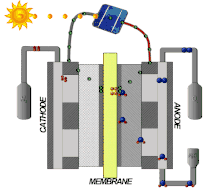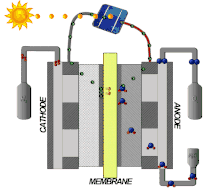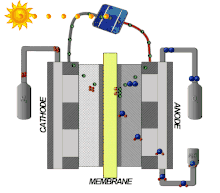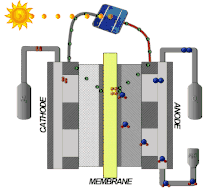
Les propriétés du Nafion le rendent intéressant pour une large gamme d'applications. Ce matériau est utilisé dans les piles à combustibles, les équipements électrochimiques, le procédé chlore-alcali, la récupération des ions de métaux, l'électrolyse de l'eau, le placage (galvanoplastie), les traitements de surface de métaux, les piles électriques, les capteurs, les systèmes de dialyse à effet Gibbs-Donnan, la délivrance des médicaments, l'humidification ou l'assèchement des gaz et la catalyse superacide pour la chimie fine[5],[6],[17].
Membrane pour cellule chlore-alcali
Le chlore Cl2, l'hydroxyde de sodium NaOH et l'hydroxyde de potassium KOH sont parmi les substances chimiques les plus produites dans le monde. Au XXIe siècle, les méthodes de production de Cl2 et de NaOH/KOH reposent sur l'électrolyse de saumures à l'aide d'une membrane en Nafion entre demi-cellules. Avant le Nafion, les industriels utilisaient des amalgames de mercure contenant du sodium pour séparer le sodium élémentaire des cellules, ou des diaphragmes en amiante pour permettre le transfert des cations de sodium entre les demi-cellules. Ces deux technologies furent développées dans la seconde moitié du XIXe siècle. L'inconvénient de ces systèmes est la sécurité des ouvriers et l'impact environnemental associés à l'utilisation de mercure et d'amiante. Des considérations économiques ont également joué un rôle, ainsi que la contamination au chlore des hydroxydes obtenus à travers un diaphragme. Le Nafion a été le résultat direct des recherches de cette industrie pour résoudre ces problèmes : il peut supporter des températures élevées, des courants électriques élevés, ainsi que le milieu corrosif des cellules électrolytiques[5],[6].
Dans une cellule chlore-alcali, le Nafion fonctionne comme une membrane entre les demi-cellules. La membrane permet aux cations de sodium Na+ de passer d'une demi-cellule à l'autre avec une résistance électrique aussi réduite que possible. La membrane peut être également renforcée avec des membranes supplémentaires pour prévenir le mélange des gaz et réduire les transferts à contre-courant des anions chlorure Cl− et hydroxyde OH−.
Piles à combustible à membrane échangeuse de protons
Les piles à combustible sont une technologie ancienne, qui remonte aux années 1960, par exemple comme sources d'énergie pour satellites artificiels[18],[19]. Depuis le début du siècle, elles font l'objet de recherches actives. Celles-ci sont motivées par les enjeux de l'hydrogène vert : de l'hydrogène H2 est produit par électrolyse de l'eau dont l'électricité est d'origine renouvelable, ce qui libère de l'oxygène O2 comme sous-produit, et non par vaporeformage de gaz naturel, qui libère du dioxyde de carbone CO2.
Le Nafion s'est révélé être un très bon matériau pour les membranes échangeuses de protons (PEM), permettant le transport des protons tout en bloquant celui des électrons, ce qui permet de réaliser des piles à combustible à PEM performantes. L'hydrogène arrive du côté combustible en libérant des électrons dans l'anode et des protons dans la membrane, protons qui traversent la membrane et se recombinent aux électrons de la cathode pour donner de l'eau H2O avec l'oxygène côté comburant[5]. Les électrodes utilisées dans ces dispositifs sont des électrodes à diffusion de gaz (GDE), par exemple en PTFE.
Catalyseurs superacides pour la chimie fine
Le Nafion est par nature un superacide pouvant être utilisé comme catalyseur en synthèse organique, par exemple pour des réactions d'alkylation, d'isomérisation, d'oligomérisation, d'acylation, de cétalisation, d'estérification, d'hydrolyse des glucides et des éthers, ainsi que des oxydations. Les applications catalytiques du Nafion ne sont peut-être pas encore toutes explorées[20]. Tous ces procédés n'ont cependant pas trouvé d'application industrielle significative.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Nafion NR50, super acidic ion exchange resin catalyst », sur Alfa Aesar (consulté le ).
- (en) A. D. Jenkins, P. Kratochvíl, R. F. T. Stepto et U. W. Suter, « Glossary of basic terms in polymer science (IUPAC Recommendations 1996) », Pure and Applied Chemistry, vol. 68, no 12, , p. 2287-2311 (DOI 10.1351/pac199668122287, lire en ligne). p. 2299 : « 1.66 Ionomer molecule: a macromolecule in which a small but significant proportion of the constitutional units have ionizable or ionic groups, or both. »
- (en) Ahmet Kusoglu et Adam Z. Weber, « New Insights into Perfluorinated Sulfonic-Acid Ionomers », Chemical Reviews, vol. 117, no 3, , p. 987-1104 (DOI 10.1021/acs.chemrev.6b00159, lire en ligne)
- (en) Carla Heitner-Wirguin, « Recent advances in perfluorinated ionomer membranes: structure, properties and applications », Journal of Membrane Science, vol. 120, no 1, , p. 1-33 (DOI 10.1016/0376-7388(96)00155-X, lire en ligne)
- (en) Kenneth A. Mauritz et Robert B. Moore, « State of Understanding of Nafion », Chemical Reviews, vol. 104, no 10, , p. 4535-4586 (PMID 15669162, DOI 10.1021/cr0207123, lire en ligne)
- (en) T. D. Gierke et W. Y. Hsu, « The Cluster—Network Model of Ion Clustering in Perfluorosulfonated Membranes », Perfluorinated Ionomer Membranes, vol. 180, (DOI 10.1021/bk-1982-0180.ch013, lire en ligne)
- (en) T. D. Gierke, G. E. Munn et F. C. Wilson, « The morphology in nafion perfluorinated membrane products, as determined by wide‐ and small‐angle x‐ray studies », Journal of Polymer Science: Polymer Physics Edition, vol. Polymer Physics, no 19, novembre, p. 1981 (DOI 10.1002/pol.1981.180191103, Bibcode 1981JPoSB..19.1687G, lire en ligne)
- (en) Klaus Schmidt-Rohr et Qiang Chen, « Parallel cylindrical water nanochannels in Nafion fuel-cell membranes », Nature Materials, vol. 7, no 1, , p. 75-83 (PMID 18066069, DOI 10.1038/nmat2074, lire en ligne)
- (en) Connolly Donald James et Gresham William Franklin pour EI Du Pont de Nemours and Co, Brevet U.S. 3282875 : Fluorocarbon vinyl ether polymers, déposé le 22 juillet 1964, publié le 1 novembre 1966, sur Google Patents.
- (en) Michael A. Hickner, Hossein Ghassemi, Yu Seung Kim, Brian R. Einsla et James E. McGrath, « Alternative Polymer Systems for Proton Exchange Membranes (PEMs) », Chemical Reviews, vol. 104, no 10, , p. 4587-4612 (PMID 15669163, DOI 10.1021/cr020711a, lire en ligne)
- (en) A. L. Dicks, « 4.08 - PEM Fuel Cells: Applications », Comprehensive Renewable Energy, vol. 4, , p. 203-245 (DOI 10.1016/B978-0-08-087872-0.00406-6, lire en ligne)
- (en) K.D. Kreuer, M. Ise, A. Fuchs et J. Maier, « Proton and water transport in nano-separated polymer membranes », Journal de Physique IV, vol. 10, no PR7, , p. 279-281 (DOI 10.1051/jp4:2000756, lire en ligne)
- (en) Yoshitsugu Sone, Per Ekdunge et Daniel Simonsson, « Proton Conductivity of Nafion 117 as Measured by a Four‐Electrode AC Impedance Method », Journal of the Electrochemical Society, vol. 143, no 4, , p. 1254 (DOI 10.1149/1.1836625, Bibcode 1996JElS..143.1254S, lire en ligne)
- (en) Maximilian Schalenbach, Tobias Hoefner, Paul Paciok, Marcelo Carmo, Wiebke Lueke et Detlef Stolten, « Gas Permeation through Nafion. Part 1: Measurements », The Journal of Physical Chemistry C, vol. 119, no 45, , p. 25145-25155 (DOI 10.1021/acs.jpcc.5b04155, lire en ligne)
- (en) Maximilian Schalenbach, Michael A. Hoeh, Jeff T. Gostick, Wiebke Lueke et Detlef Stolten, « Gas Permeation through Nafion. Part 2: Resistor Network Model », The Journal of Physical Chemistry C, vol. 119, no 45, , p. 25156-25169 (DOI 10.1021/acs.jpcc.5b04157, lire en ligne)
- (en) Georges Gelbard, « Organic Synthesis by Catalysis with Ion-Exchange Resins », Industrial & Engineering Chemistry Research, vol. 44, no 23, , p. 8468-8498 (DOI 10.1021/ie0580405, lire en ligne)
- (en) Justin Fitzgerald et Nancy O'Bryan, « Fuel Cells: A Better Energy Source for Earth and Space », sur https://www.nasa.gov/centers/glenn/, Glenn Research Center, (consulté le ).
- (en) Brian Dunbar et Nancy Bray, « Space Applications of Hydrogen and Fuel Cells », sur https://www.nasa.gov/, NASA, (consulté le ).
- (en) Georges Gelbard, « Organic Synthesis by Catalysis with Ion-Exchange Resins », Industrial & Engineering Chemistry Research, vol. 44, no 23, , p. 8468-8498 (DOI 10.1021/ie0580405, lire en ligne)
- Portail de la chimie
