Bicuspidie valvulaire aortique
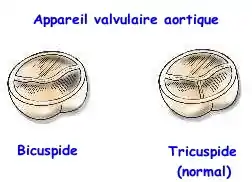
La bicuspidie valvulaire aortique est une malformation congénitale relativement fréquente de l'appareil valvulaire aortique (valve aortique) qui n'est constitué que de deux feuillets (ou cusps) fonctionnels au lieu de trois comme normalement.
| Spécialité | Cardiologie |
|---|
| CIM-10 | Q23.1 |
|---|---|
| CIM-9 | 746.4 |
| OMIM | 109730 |
| DiseasesDB | 1392 |
| MedlinePlus | 007325 |
| eMedicine | 893523 |
| MeSH | D000082882 |
![]() Mise en garde médicale
Mise en garde médicale
Épidémiologie
Elle est retrouvée dans 1 à 2 % de la population[1]. Son incidence serait donc de 8000 à 16000 nouveaux cas chaque année en France, ce qui en fait, de très loin, la malformation cardiaque congénitale la plus fréquente. Elle est trois fois plus fréquente chez les garçons que chez les filles[2].
La bicuspidie est le plus souvent isolée mais diverses malformations congénitales sont fréquemment associées à une bicuspidie qui devra alors être recherchée systématiquement[2]. Ainsi plus de 50 % des enfants présentant une coarctation de l'aorte sont également porteurs d'une bicuspidie[3], celle-ci étant également anormalement fréquente en cas de syndrome de Turner[4].
Enfin, une origine génétique est fortement suspectée[5], indiquant un dépistage systématique dans les familles dont un membre est atteint. Le ou les gènes responsables ne sont pas encore clairement identifiés.
Anatomie - Physiologie
La première description est attribuée à Léonard de Vinci qui a esquissé le croquis de cette variante anatomique de la valve aortique il y a plus de 400 ans.
Embryologie
La formation des valves aortiques (et pulmonaires) dérive d'excroissances mésenchymateuses dénommées « coussinets cardiaques » et situées dans la chambre de chasse du ventricule primitif. Elles sont normalement au nombre de six, trois pour la future aorte et trois pour le futur tronc pulmonaire.
La présence d'une bicuspidie serait liée non à l'agénésie d'un coussinet mais à la fusion de deux coussinets adjacents par un déterminisme encore mal connu; peut être en rapport avec une évolution anormale de cellules ayant migré de la crête neurale[6].
Anatomie
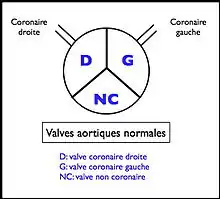
Normalement, l'appareil valvulaire aortique (séparant le ventricule gauche de l'aorte) est constitué de 3 valves sigmoïdes fermant chacune 1/3 de l'orifice (ces valves pouvant être légèrement inégales) :
- une valve dite « coronaire droite » située en regard de l'abouchement de la coronaire droite ;
- une valve dite « coronaire gauche » située en regard de l'abouchement du tronc commun de la coronaire gauche ;
- une valve dite « non coronaire », postérieure aux deux autres.
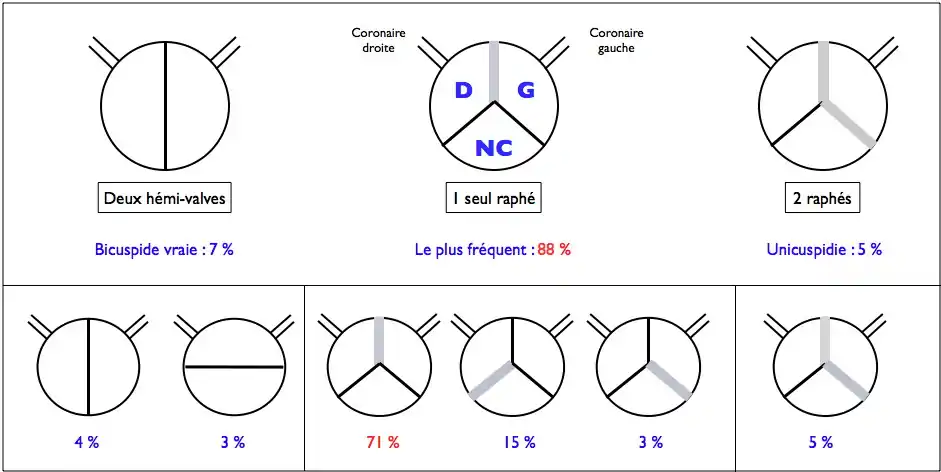
Le terme de bicuspidie regroupe plusieurs formes anatomiques[7] :
- un appareil valvulaire constitué réellement de deux valvules anatomiques (7 % des cas), chacune étant en position latérale (et chacune en regard d'un orifice coronaire) ou en position antéro-postérieure (les orifices coronaires étant tous deux en regard de la valvule, antérieure) ;
- un appareil avec deux valvules fonctionnelles, mais trois valvules anatomiques, deux d'entre elles étant fusionnées par un raphé médian. C'est la forme la plus fréquente (88 % des cas) et parmi les trois variantes possibles, la plus fréquente est celle où ce sont les valves coronaires qui sont fusionnées (71 % des cas) ;
- exceptionnellement, les trois valves peuvent être fusionnées entre elles par deux raphés, donnant une unicuspidie aortique (5 % des cas).
Il ne semble pas que le niveau où se trouve le raphé soit un facteur évolutif[2].
À part, il faut distinguer les fausses bicuspidies où la fusion commissurale entre deux valves n'est pas congénitale mais acquise à la suite d'un rhumatisme articulaire aigu ou d'une endocardite infectieuse.
Physiopathologie
Physiologiquement, un appareil valvulaire formé de trois cusps est le mieux adapté pour fermer un orifice sphérique comme un anneau artériel. Il permet un effacement optimum de chaque valve au moment de la contraction cardiaque (systole) et une occlusion parfaite de l'orifice lors de la "diastole", évitant ainsi le reflux de sang de l'aorte dans le ventricule gauche (insuffisance des valves aortiques).
Une bicuspidie est moins bien adaptée :
- soit il y a un excès de tissu valvulaire. Les deux valves s'effacent correctement (pas de rétrécissement significatif mais éventuellement un passage turbulent) mais l'une d'elles, trop grande, tend à « capoter » dans le ventricule gauche en diastole, tôt ou tard à l'origine d'une insuffisance aortique ;
- soit il y a un défaut de tissu valvulaire et les deux valves (ou une seule) ne s'efface(nt) que partiellement, à l'origine d'un certain degré de rétrécissement valvulaire aortique qui tend à se majorer avec le temps.
La bicuspidie peut être associée à des anomalies de l'aorte. Elles sont dues à des modifications au niveau de la structure cellulaire : déficit en fibrilline 1 et augmentation de l'activité des métalloprotéinases[8]. Cela entraîne une dilatation de l'aorte initiale pouvant aller jusqu'à l'anévrisme.
Diagnostic
À l'auscultation, une bicuspidie se signale classiquement par la présence d'un clic protosystolique, c'est-à-dire d'un bruit sec survenant tout au début de la contraction ventriculaire (systole). Selon qu'elle se complique ou non de rétrécissement ou d'insuffisance aortique, on peut également percevoir un souffle systolique (succédant immédiatement au clic) ou, plus difficilement, un souffle diastolique témoignant de la régurgitation valvulaire.
En fait, une bicuspidie peut rester parfaitement silencieuse. Le diagnostic sera alors posé lors d'un examen écho-doppler cardiaque pratiqué pour un autre motif. La visualisation et l'identification des différentes sigmoïdes de la valve aortique peut cependant être complexe, surtout si elles sont calcifiées. Une échographie transœsophagienne peut aider alors pour préciser le diagnostic.
Un scanner ou une IRM cardiaque peuvent mieux préciser les lésions si l'échocardiographie ne suffit pas, en particulier pour mesurer la dilatation de l'aorte thoracique[9].
Conséquences
Si dans la majorité des cas cette particularité anatomique ne donne aucun symptôme ou que des symptômes à un âge avancé (voir plus bas), entre un quart et un tiers des bicuspidies sont susceptibles de se compliquer tôt ou tard[10],[11] d'où l'intérêt d'en poser le diagnostic et la nécessité d'un suivi régulier. Les manifestations durant l'enfance sont rares.
Un appareil valvulaire bicuspide est responsable de turbulences du flux sanguin et tend à « vieillir » (dégénérescence, calcification) plus précocement qu'un appareil valvulaire normal comportant trois valves. Ceci explique que même si elle est parfaitement asymptomatique dans l'enfance, une bicuspidie puisse s'accompagner d'un rétrécissement aortique pouvant être significatif dès l'adolescence ou chez l'adulte jeune. De façon plus générale, une bicuspidie est retrouvée dans plus de la moitié des rétrécissements aortiques opérés[12].
Les cusps de la valve aortique étant de mauvaise qualité, il existe généralement un prolapsus de la plus grande ; c'est ainsi qu'une fuite aortique lui est souvent associée.
Elle peut être associée à une dilatation de l'aorte[13] pouvant aller jusqu'à l'anévrisme. C'est essentiellement la partie moyenne de l'aorte ascendante qui est concernée, avec une relative préservation de la racine aortique. Cette atteinte vasculaire est d'autant plus sévère que la valvulopathie est significative au niveau hémodynamique[14]. Cette dilatation se constitue très progressivement[15] et nécessite une surveillance. Elle peut être visualisée en échocardiographie mais parfois difficilement : un scanner thoracique ou une IRM apporte de meilleurs renseignements.
Elle s'associe à des complications telles la dissection aortique (surtout chez l'homme jeune[16]) ou l'endocardite infectieuse. Cette dernière est cependant rare et la bicuspidie n'est plus considérée comme un terrain à risque imposant une prévention par prise d'antibiotiques en cas de soins dentaires (prophylaxie de l'endocardite)[17].
Traitement
La prise en charge des valvulopathies a fait l'objet de la publication de recommandations. Celles, américaines, ont été mises à jour en 2020[9].
C'est celui des complications : remplacement valvulaire en cas de rétrécissement ou de fuite aortique importante (chirurgie conventionnelle ou TAVI[18]), cure de l'anévrisme aortique[19] dépendant essentiellement du diamètre de ce dernier[20]...
Une hypertension artérielle peut aggraver la dilatation de l'aorte et doit être rigoureusement traitée.
Dans les formes non compliquées, il n'existe aucune contre-indication à une pratique sportive[21].
La mise sous bêta-bloquants est habituelle en cas de dilatation de l'aorte ascendante[19] même si l'efficacité de ce traitement n'a pas été prouvée.
Surveillance
Dans les formes non compliquées, une échocardiographie annuelle ou tous les deux ans est conseillée[22]. Elle permet de vérifier l'existence ou non d'une augmentation de la fuite aortique, de son retentissement sur le ventricule gauche, mais aussi l'évolution du calibre de l'aorte ascendante, en particulier si son diamètre dépasse 40 mm[9].
Devant l'existence de formes familiales, un dépistage par échocardiographie chez les apparentés du premier degré peut être conseillé[9].
Notes et références
- Recommandations de la Société Française de Cardiologie concernant la prise en charge des valvulopathies acquises et des dysfonctions de prothèse valvulaire. . Site de la SFC - Page visitée le 10/05/2007 .
- (en) Siu SC, Silversides CK, « Bicuspid aortic valve disease » J Am Coll Cardiol. 2010:55;2789-2800
- (en) Roos-Hesselink JW, Scholzel BE, Heijdra RJ et al. « Aortic valve and aortic arch pathology after coarctation repair » Heart 2003;89:1074-7.
- (en) Sybert VP. « Cardiovascular malformations and complications in Turner syndrome » Pediatrics 101:E11, 1998
- (en) Cripe L, Andelfinger G, Martin LJ et al. « Bicuspid aortic valve is heritable » J Am Coll Cardiol. 2004;44:138–43
- (en) Sans-Coma V, Fernandez B, Duran AC et al. « Fusion of valve cushions as a key factor in the formation of congenital bicuspid aortic valves in Syrian hamsters » Anat. Rec. 1996;244:490-8.
- (en) Sievers H.H, Schmidtke C.A. « Classification system for the bicuspid aortic valve from 304 surgical specimens » J Thorac Cardiovasc Surg. 2007; 133: 1226-33
- (en) Fedak PW, de Sa MP, Verma S et al. « Vascular matrix remodeling in patients with bicuspid aortic valve malformations: implications for aortic dilatation » J Thorac Cardiovasc Surg. 2003:126;797–806.
- (en) Otto CM, Nishimura RA, Bonow RO et al. « 2020 ACC/AHA guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines », Circulation, 2021;143:e72–e227
- (en) Michelena HI, Desjardins VA, Avierinos JF et al. « Natural history of asymptomatic patients with normally functioning or minimally dysfunctional bicuspid aortic valve in the community » Circulation 2008;117:2776–2784
- (en) Tzemos N, Therrien J, Yip J et al. « Outcomes in adults with bicuspid aortic valves » JAMA 2008;300:1317–1325
- (en) Roberts WC, Ko JM, « Frequency by decades of unicuspid, bicuspid, and tricuspid aortic valves in adults having isolated aortic valve replacement for aortic stenosis, with or without associated aortic regurgitation » Circulation 2005;111:920-925
- (en) Cecconi M, Manfrin M, Moraca A et al. « Aortic dimensions in patients with bicuspid aortic valve without significant valve dysfunction » Am J Cardiol. 2005;95:292–4
- (en) Della Corte A, Bancone C, Quarto C et al. « Predictors of ascending aortic dilatation with bicuspid aortic valve: a wide spectrum of disease expression » Eur J Cardiothorac Surg. 2007;31:397–405
- (en) Braverman AC, « Diseases of the aorta: Aortic involvement in patients with a bicuspid aortic valve » Heart 2011;97:506-513
- (en) Januzzi JL, Isselbacher EM, Fattori R et al. « Characterizing the young patient with aortic dissection: results from the International Registry of Aortic Dissection (IRAD) » J Am Coll Cardiol. 2004;43:665–9
- (en) Nishimura RA, Carabello BA, Faxon DP et al. « ACC/AHA 2008 guideline update on valvular heart disease: focused update on infective endocarditis: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines » J Am Coll Cardiol. 2008;52:676–685.
- (en) Halim SA, Edwards FH, Dai D et al. « Outcomes of transcatheter aortic valve replacement in patients with bicuspid aortic valve disease, a report from the Society of Thoracic Surgeons/American College of Cardiology Transcatheter Valve Therapy Registry » Circulation, 2020;141:1071–1079
- (en) Bonow RO, Carabello B, Chatterjee K et al. « ACC/AHA 2006 Guidelines for the Management of Patients With Valvular Heart Disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1998 Guidelines for the Management of Patients with Valvular Heart Disease) » J Am Coll Cardiol. 2006;48:e1–148
- (en) Hiratzka LF, Creager MA, « Surgery for aortic dilatation in patients with bicuspid aortic valves : A statement of clarification from the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines » J Am Coll Cardiol 2016;67(6):724–31.
- (en) Graham TP Jr., Driscoll DJ, Gersony WH et al. « Task Force 2: congenital heart disease » J Am Coll Cardiol. 2005;45:1326–1333
- (en) Warnes CA, Williams RG, Bashore TM et al. « ACC/AHA 2008 guidelines for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines » J Am Coll Cardiol. 2008;52:e1–e121