Boléite
La boléite est une espèce minérale composée d'hydroxy-halogénure de plomb et de cuivre de formule KPb26Ag9Cu24Cl62(OH)48[3].
| Boléite Catégorie III : halogénures[1] | |
 Boléite - Mine Amelie, Boleo Mine, Santa Rosalía, Basse-Californie du Sud, Mexique (cristal 8 mm) | |
| Général | |
|---|---|
| Numéro CAS | |
| Classe de Strunz | 3.DB.15
|
| Classe de Dana | 10.06.06.01
|
| Formule chimique | KPb26Ag9Cu24Cl62(OH)48 |
| Identification | |
| Masse formulaire[2] | 10 936,7 ± 2,8 uma H 0,44 %, Ag 8,88 %, Cl 20,1 %, Cu 13,94 %, K 0,36 %, O 7,02 %, Pb 49,26 %, |
| Couleur | bleu vif à bleu de Prusse, bleu indigo en LP |
| Classe cristalline et groupe d'espace | hexakisoctaédrique, Pm3m |
| Système cristallin | cubique |
| Réseau de Bravais | primitif P |
| Clivage | parfait sur {001}, bon sur {101} |
| Échelle de Mohs | 3 - 3,5 |
| Trait | bleu-vert clair |
| Éclat | vitreux à nacré |
| Propriétés optiques | |
| Indice de réfraction | n=2,05 |
| Pléochroïsme | nul |
| Biréfringence | Δ=0,000 (isotrope) |
| Dispersion | 2 vz ~ nulle |
| Transparence | translucide |
| Propriétés chimiques | |
| Densité | 4,95 |
| Fusibilité | fond et donne une boulette magnétique |
| Solubilité | difficilement soluble dans HCl |
| Propriétés physiques | |
| Radioactivité | à peine détectable |
| Unités du SI & CNTP, sauf indication contraire. | |
Historique de la description et appellations
Inventeur et étymologie
La boléite a été décrite conjointement par François Ernest Mallard et Édouard Cumenge en 1891[4]. Le nom de la boléite est inspiré de la localité-type, Boleo au Mexique[5].
Topotype
Le gisement topotype est localisé dans la mine Amelie, Boleo Mine, Santa Rosalía, Basse-Californie du Sud, Mexique.
Caractéristiques physico-chimiques
Critères de détermination
La boléite se présente le plus souvent sous forme de cristaux cubiques d'un bleu intense inclus dans une gangue constituée d'autres minéraux, mais parfois aussi sous forme de croûte bleue régulière ou de géodes créées au sein d'anciennes haldes[8]. Ces cristaux peuvent être de translucides à opaques, avec un éclat pouvant varier de vitreux à nacré. Vus au microscope polariseur analyseur, en lumière analysée, ils passent du bleu indigo au noir. Ces cristaux présentent un clivage parfait, mais leur fracture est conchoïdale.
C'est un minéral plutôt tendre (3 à 3,5 sur l'échelle de Mohs), mais assez dense puisque la densité mesurée est de 5,05[9].
Lorsqu'on le fait fondre, ce minéral forme une boulette magnétisée. Certains échantillons sont de plus faiblement radioactifs.
La boléite laisse un trait bleu-vert clair ou vert clair. Elle se dissout difficilement dans l'acide chlorhydrique.
Composition chimique
La boléite, de formule KPb26Ag9Cu24Cl62(OH)48, a une masse moléculaire de 10936,93 u. Elle est donc composée des éléments suivants :
| Élément | Nombre (formule) | Masse des atomes (u) | % de la masse moléculaire |
|---|---|---|---|
| Potassium | 1 | 39,10 | 0,36 % |
| Argent | 9 | 970,81 | 8,88 % |
| Cuivre | 24 | 1 525,11 | 13,94 % |
| Plomb | 26 | 5 387,46 | 49,26 % |
| Hydrogène | 48 | 48,38 | 0,44 % |
| Oxygène | 48 | 767,97 | 7,02 % |
| Chlore | 62 | 2 198,10 | 20,10 % |
| Total : 218 éléments | Total : 10936,93 u | Total : 100 % |
Cristallochimie
Sa composition chimique place ce minéral :
- dans le groupe 3.DB.15 selon la classification de Strunz : catégorie des halogénures (III), sous-groupe des oxyhalogénures, hydroxyhalogénures et halogénures doubles apparentés (03.D), contenant notamment du plomb et du cuivre (03.DB) ;
- dans le groupe 10.06.06 selon la classification de Dana : groupe des oxyhalogénures et hydroxyhalogénures (10) de formule chimique AmBn(O,OH)pXq (10.06).
Ces deux groupes ne contiennent que la boléite comme membre.
Cristallographie
La boléite cristallise dans le système cristallin cubique, de classe hexakisoctaédrique, dans le groupe d'espace Pm3m (Z = 1 unité formulaire par maille)[3]. Le paramètre de la maille conventionnelle est = 15,288 Å (volume de la maille V = 3 573 Å3). La masse volumique calculée est de 5,08 g/cm3.
Les atomes de potassium sont en coordination (12) cuboctaédrique de chlore et forment des groupes KCl12.
Les atomes de plomb sont répartis sur trois sites non-équivalents d'environnements différents :
- coordination (8) tétragonale antiprismatique déformée de chlore : groupes PbCl8 ;
- coordination (6+3) de chlore et de groupes hydroxyles : groupes PbCl6(OH)3 ;
- coordination (6+2) trigonale prismatique déformée de chlore avec un groupe hydroxyle au-dessus de deux des faces : groupes PbCl6(OH)2.
Les atomes d'argent sont répartis sur deux sites non-équivalents d'environnements différents :
- coordination (5) tétragonale pyramidale déformée de chlore : groupes AgCl5 ;
- coordination (6) octaédrique aplatie de chlore : groupes AgCl6.
Les groupes AgCl5 sont reliés par les arêtes de leur base quadratique et forment des groupes Ag6Cl14, dans lesquels les atomes d'argent sont arrangés aux sommets d'un octaèdre régulier ; ces groupes sont reliés entre eux dans les trois directions de l'espace {100} par les sommets des octaèdres AgCl6.
Les atomes de cuivre sont en coordination (4+2) octaédrique déformée de groupes hydroxyles et de chlore. La distribution des longueurs de liaison dans les octaèdres CuCl2(OH)4, quatre liaisons Cu-O courtes (1,96 Å et 1,97 Å) et deux liaisons Cu-Cl plus longues (2,82 Å et 2,92 Å), est typique de l'effet Jahn-Teller rencontré dans les composés de Cu(II) et permet une description alternative de la structure en termes de groupes plans carrés Cu(OH)4. Dans cette description, les groupes Cu(OH)4 sont reliés par leurs arêtes et forment des dimères Cu2(OH)6 ; ces dimères sont reliés par leurs sommets et forment des cages Cu24(OH)48 ouvertes dans les directions {100}, contenant les groupes Ag6Cl14.
 Structure de la boléite projetée dans le plan (a, b). Violet : Pb, noir : Ag, rouge : Cu, cyan : K, vert : Cl, bleu : O, gris : H. Le parallélépipède noir représente la maille conventionnelle.
Structure de la boléite projetée dans le plan (a, b). Violet : Pb, noir : Ag, rouge : Cu, cyan : K, vert : Cl, bleu : O, gris : H. Le parallélépipède noir représente la maille conventionnelle.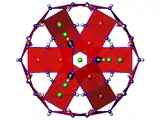 Cage ouverte de cuivre, projetée selon la direction [111].
Cage ouverte de cuivre, projetée selon la direction [111].
Gîtes et gisements

Gîtologie et minéraux associés
C'est un minéral rare qui se rencontre dans les zones sédimentaires d’oxydation du cuivre, ayant été immergées par l’eau de mer. Il se forme par réaction chimique entre les chlorures de l'eau salée avec les sulfures présents dans les zones de dépôts de plomb et de cuivre. De la boléite peut aussi se former dans des scories de fonderie placées en contact avec de l'eau de mer[9].
La boléite peut être associée notamment à la pseudoboléite, à l'atacamite, à l'anglésite, à la cérusite, à la phosgénite et à la cumengéite[9].
Gisements remarquables
- Newporth Beach, Falmouth, Helford - Région de Falmouth, Cornouailles[9]
- Dépôts de St. Anthony dans la Mammoth-Saint Anthony Mine, Tiger (ville-fantôme), district de Mammoth, Comté de Pinal, Arizona[10]
- Mine Amelie, Boleo Mine, Santa Rosalía, Basse-Californie du Sud
Galerie
 Mexique, 3×2×1,5 cm
Mexique, 3×2×1,5 cm Mexique, 6,5×4×3,5 cm
Mexique, 6,5×4×3,5 cm Mexique, 0,8×0,7×0,7 cm
Mexique, 0,8×0,7×0,7 cm
Notes et références
- La classification des minéraux choisie est celle de Strunz, à l'exception des polymorphes de la silice, qui sont classés parmi les silicates.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ICSD No. 56 964 ; (en) Mark A. Cooper et Frank C. Hawthorne, « Boleite: Resolution of the Formula, KPb26Ag9Cu24Cl62(OH)48 », The Canadian Mineralogist, vol. 38, no 4, , p. 801-808 (DOI 10.2113/gscanmin.38.4.801)
- Mallard et E. Cumenge, « Sur une nouvelle espèce minérale, la Boléite », Comptes rendus hebdomadaires des séances de l’Académie des sciences de Paris, vol. 113, , p. 519-524 (lire en ligne)
- « Minéraux et étymologie », sur MINER Database, Jacques Lapaire (consulté le )
- « Index alphabétique de nomenclature minéralogique »
- (de) Schultze, dans Chemiker-Zeitung Cöthen, vol. 16, 1892, p. 195
- Rupert Hochleitner (trad. de l'allemand), 300 roches et minéraux, Paris, Delachaux et Niestlé, , 256 p. (ISBN 978-2-603-01698-5), p. 19
- (en) John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh et Monte C. Nichols, The Handbook of Mineralogy : Halides, Hydroxides, Oxides, vol. III, Mineral Data Publishing, (lire en ligne), p. 72.
- (en) John W. Anthony, Sidney A. Williams, Richard A. Bideaux, Raymond W. Grant et Wendell E. Wilson, Mineralogy of Arizona, , 3e éd., p. 141
- « Liste alphabétique des minéraux de la mine de Cap Garonne », sur Musée de la Mine de Cap Garonne (consulté le )
Voir aussi
- Portail des minéraux et roches
- Portail de la chimie