Borane
Cet article concerne un composé spécifique. Pour la classe de composés, voir boranes.
| Borane | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | borane | |
| Synonymes |
borine, trihydrure de bore, trihydridobore |
|
| No CAS | ||
| PubChem | 6331 | |
| ChEBI | 30149 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | BH3 | |
| Masse molaire[1] | 13,835 ± 0,007 g/mol H 21,86 %, B 78,14 %, |
|
| Moment dipolaire | 0 D[réf. souhaitée] | |
| Thermochimie | ||
| S0gaz, 1 bar | 187,88 kJ mol−1 K−1[réf. souhaitée] | |
| ΔfH0gaz | 106,69 kJ/mol[réf. souhaitée] | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 12,026 ± 0,024 eV (gaz)[2] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Ne doit pas être confondu avec bornane.
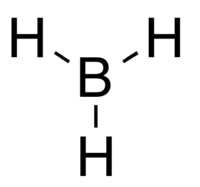
Le borane (trihydridobore en nomenclature systématique), est une molécule instable et hautement réactive répondant à la formule chimique BH3.
L'espèce moléculaire BH3 est un acide de Lewis très fort. Par conséquent, il est hautement réactif et ne peut être observé directement que sous forme de produit continu, transitoire, dans un système à flux ou lors de la réaction de bore atomique ablaté au laser avec de l’hydrogène.
C'est un gaz incolore impossible à concentrer sous sa forme pure. Le borane est l'élément le plus simple de la famille des boranes ainsi que le prototype des monoboranes.
Structure et propriétés
BH3 est une molécule trigonale plane (AX3E0) présentant une symétrie D3h. La longueur de la liaison B – H déterminée expérimentalement est de 119 pm[réf. souhaitée].
En l'absence d'autres espèces chimiques, il réagit avec lui-même pour former du diborane. Il s’agit donc d’un produit intermédiaire dans la préparation du diborane en fonction de la réaction :
- BX3 + BH4− → HBX3− + (BH3) (X = F, Cl, Br, I)
- 2 BH3 → B2H6
L'enthalpie standard de dimérisation de BH3 est estimée à −170 kJ mol−1. L'atome de bore dans BH3 a six électrons de valence. Par conséquent, il s'agit d'un acide de Lewis fort qui réagit avec toute base de Lewis, L, pour former un produit d'addition dans lequel la base donne sa paire unique, formant une liaison covalente dative.
- BH3 + L → L—BH3
De tels composés sont thermodynamiquement stables, mais peuvent être facilement oxydés à l'air libre. Des solutions contenant du diméthylsulfure de borane et du tétrahydrofurane de borane sont disponibles dans le commerce ; dans le tétrahydrofurane, un agent stabilisant est ajouté pour empêcher le THF d’oxyder le borane.
Le borane est également utilisé en pratique pour réduire des acides carboxyliques en alcools primaires.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of Chemistry and Physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- Portail de la chimie