Carbonate de zinc
Le carbonate de zinc est un composé chimique de formule ZnCO3. C'est un sel de zinc Zn2+ et de carbonate CO32−. Il se présente sous la forme d'une poudre blanche cristallisée dans le système trigonal donnant des cristaux de structure rhomboédrique. Ces cristaux sont généralement bleus ou verts, mais il existe également des cristaux incolores, blancs, jaune pâle et marron. Il est présent naturellement dans la smithsonite.
| Carbonate de zinc | |
 |
|
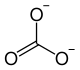
| Ions constituant le carbonate de zinc | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.020.435 |
| No CE | 222-477-6 |
| PubChem | 19005 |
| SMILES | |
| InChI | |
| Apparence | poudre cristallisée inodore et incolore à jaunâtre[1] |
| Propriétés chimiques | |
| Formule | CO3Zn |
| Masse molaire[2] | 125,39 ± 0,02 g/mol C 9,58 %, O 38,28 %, Zn 52,15 %, |
| Propriétés physiques | |
| T° fusion | décomposition à environ 300 °C[1] |
| Solubilité | 10 mg·L-1[1] à 15 °C |
| Masse volumique | 4,4 g·cm-3[1] |
| Précautions | |
| SGH[1] | |
 Attention |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le carbonate de zinc est chimiquement semblable au carbonate de calcium CaCO3, à la différence qu'il ne forme pas de précipités sulfurés par addition d'acide sulfhydrique H2S. Il est soluble dans les acides et peut être converti en oxyde de zinc ZnO par un processus de recuit :
Il peut être dissous dans les solutions fortement basiques en formant des complexes incolores de tétrahydroxozincate (en) Zn(OH)42−.
Du carbonate de zinc peut être obtenu en faisant réagir des sels de zinc avec du bicarbonate de potassium[3] KHCO3 :
- ZnSO4 + 4 KHCO3 ⟶ ZnCO3 + K2SO4 + K2CO3 + 2 CO2 + 2 H2O ;
- ZnCl2 + 4 KHCO3 + n CO2 ⟶ ZnCO3 + 2 KCl + K2CO3 + (n + 2) CO2 + 2 H2O.
Le carbonate de zinc est utilisé comme pigment et est inclus dans des préparations pharmaceutiques. On l'utilise également pour la production de pigments à base d'oxyde de zinc, pour l'absorption du sulfure d'hydrogène lors du forage de puits profonds, et dans la teinture et l'impression des textiles. De plus, il est utilisé comme activateur pour la vulcanisation par le soufre ou par thiurames d'articles en caoutchouc semi-transparents et translucides, comme agent de vulcanisation pour élastomères carboxylés, ainsi que pour la production d'articles de plongée sous-marine en latex.
La protection contre la corrosion offerte par la galvanisation à chaud est due à la formation de couches protectrices sur les surfaces traitées, couches protectrices constituées largement de carbonate de zinc.
Notes et références
- Entrée « Zinc carbonate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 juin 2018 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Georg Brauer, Handbuch der Präparativen Anorganischen Chemie, 3e réédition, vol. 2, Enke, Stuttgart, 1978, p. 1035. (ISBN 3-432-87813-3)
- Portail de la chimie
