Chimie des composés en C1
La chimie des composés en C1 ou chimie C1 est la chimie des molécules à un seul atome de carbone. Bien que de nombreux composés et ions ne contiennent qu'un seul carbone, la recherche se concentre sur les matières premières stables et abondantes en C1. Quatre composés sont d'une importance industrielle majeure : le méthane, le monoxyde de carbone, le dioxyde de carbone et le méthanol. Les technologies qui interconvertissent ces espèces sont d'un intérêt majeur[1].

Procédés industriels
Le monoxyde de carbone et le méthanol sont des matières premières chimiques importantes. Le CO est utilisé par une myriade de réactions de carbonylation. Avec le dihydrogène, il alimente le procédé Fischer-Tropsch qui permet d'obtenir des hydrocarbures liquides. Le méthanol est le précurseur de l'acide acétique, de l'éther diméthylique, du formaldéhyde et de nombreux composés méthyliques (esters, amines, halogénures). Une application à plus grande échelle est le procédé MTO (methanol to olefins) qui permet de produire de l'éthylène et du propylène[2].

Contrairement au monoxyde de carbone et au méthanol, le méthane et le dioxyde de carbone ont des utilisations limitées en tant que matières premières pour la production d'autres composés chimiques et de carburants. Cette disparité contraste avec l'abondance relative du méthane et du dioxyde de carbone. Le méthane est souvent partiellement converti en monoxyde de carbone pour être utilisé dans le procédé Fischer-Tropsch. L'intérêt de la valorisation du méthane réside dans son couplage oxydatif (en) :
- 2CH4 + O2 → C2H4 + 2H2O
Parmi les techniques de conversion du dioxyde de carbone, on peut parler de sa réduction électrochimique (en) en hydrocarbures insaturés. S'il a été possible dès le XIXe siècle de convertir électochimiquement le dioxyde de carbone en monoxyde de carbone, et que la recherche dans le secteur s'est intensifiée dans les années 1980, il n'existe à l'heure actuelle aucune installation industrielle de traitement du CO2.
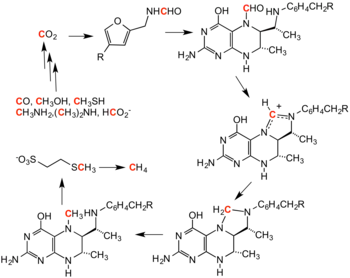
Biochimie
Le méthane, le monoxyde de carbone, le dioxyde de carbone et le méthanol sont aussi des substrats et des produit de procédés enzymatiques. Dans la méthanogenèse, le monoxyde de carbone, le dioxyde de carbone et le méthanol sont convertis en méthane, si des réducteurs adéquats sont apportés[3] La méthanogénèse par les archées méthanogènes est réversible[4].
Dans la photosynthèse,le dioxyde de carbone et l'eau sont convertis en sucres (et en O2), l'énergie (thermique) pour cette réaction très énergivore venant de la lumière du soleil.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « C1 chemistry » (voir la liste des auteurs).
- Carl Mesters, « A Selection of Recent Advances in C1 Chemistry », Annual Review of Chemical and Biomolecular Engineering, vol. 7, , p. 223–38 (PMID 27276549, DOI 10.1146/annurev-chembioeng-080615-034616)
- Tian, P.; Wei, Y.; Ye, M.; Liu, Z., « Methanol to Olefins (MTO): From Fundamentals to Commercialization », ACS Catal., vol. 5, , p. 1922–1938 (DOI 10.1021/acscatal.5b00007)
- Thauer, R. K., « Biochemistry of Methanogenesis: a Tribute to Marjory Stephenson », Microbiology, vol. 144, , p. 2377–2406 (PMID 9782487, DOI 10.1099/00221287-144-9-2377)
- Silvan Scheller, Meike Goenrich, Reinhard Boecher, Rudolf K. Thauer et Bernhard Jaun, « The key nickel enzyme of methanogenesis catalyses the anaerobic oxidation of methane », Nature, vol. 465, no 7298, , p. 606–608 (ISSN 1476-4687, PMID 20520712, DOI 10.1038/nature09015, Bibcode 2010Natur.465..606S)
- Portail de la chimie