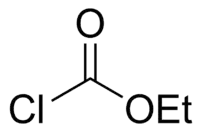
Chloroformiate d'éthyle
Le chloroformiate d'éthyle est l'ester d'éthyle de l'acide chloroformique. C'est un réactif utilisé en synthèse organique pour l'introduction du groupe protecteur carbamate d'éthyle[4] et la formation d'anhydrides carboxyliques.
| Chloroformiate d'éthyle | |
| |
| Identification | |
|---|---|
| Nom UICPA | ester d'éthyle de l'acide chloroformique |
| No CAS | |
| No ECHA | 100.007.981 |
| No CE | 208-778-5 |
| PubChem | 10928 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore[1] |
| Propriétés chimiques | |
| Formule | C3H5ClO2 |
| Masse molaire[2] | 108,524 ± 0,005 g/mol C 33,2 %, H 4,64 %, Cl 32,67 %, O 29,49 %, |
| Propriétés physiques | |
| T° fusion | −80,6 °C[1] |
| T° ébullition | 93 °C[1] |
| Solubilité | se décompose dans l'eau[1] |
| Masse volumique | 1,14 g·cm-3 (20 °C)[1] |
| T° d'auto-inflammation | 500 °C[1] |
| Point d’éclair | 16 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 3,7-12,6 vol. %[1] |
| Pression de vapeur saturante | 54,6 mbar (20 °C)[1] 215 mbar (50 °C)[1] 385 mbar (65 °C)[1] |
| Conductivité électrique | 1,45×10-7 S·m-1 (20 °C)[1] |
| Propriétés optiques | |
| Indice de réfraction | 1,395[3] |
| Précautions | |
| SGH[1] | |
   Danger |
|
| NFPA 704[3] | |
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 270 mg/kg (rat, oral)[3] 7,120 mg/kg (lapin, dermique)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il appartient à la classes des chloroformiates, comme le chloroformiate de méthyle, le chloroformiate de benzyle ou le chlorure de benzyloxycarbonyle.
Propriétés
Le chloroformiate d'éthyle se décompose dans l'eau ou lorsqu'il est chauffé, en chlorure d'hydrogène, phosgène et en dioxine (dans le feu). Il réagit dangereusement avec les bases, les alcools, les oxydants, l'ammoniac et l'eau. Il présente des risques d'explosion an contact avec les alcalins/alcalino-terreux[1].
Synthèse
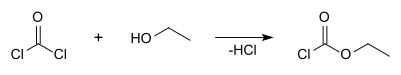
Le chloroformiate d'éthyle peut être obtenu par réaction entre le phosgène et l'éthanol anhydre[5] :
Utilisation
Le chloroformiate d'éthyle est utilisé couramment comme intermédiaire dans la préparation de carbonates et de carbamates[5], utilisés comme réactifs dans l'industrie pharmaceutique.
Notes et références
- Entrée « Ethyl chloroformate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1er Décembre 2012 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Ethyl chloroformate, consultée le 1er décembre 2012.
- Protective Groups in Organic Synthesis, Third Edition, Theodora W. Greene and Peter G. M. Wuts, pages 504-506, (ISBN 0-471-16019-9)
- chemicalland21.com: Produktinformation
- Portail de la chimie