Chloroformiate de méthyle
Le chloroformiate de méthyle est un composé chimique de formule ClCOOCH3. Il s'agit d'un liquide huileux incolore teinté de jaune, très inflammable, d'odeur piquante, susceptible de former des mélanges explosifs avec l'air. Il se décompose lentement au contact de l'eau, en dégageant de l'acide chlorhydrique HCl (aq), du monoxyde de carbone CO et du méthanol CH3OH. Il libère du phosgène COCl2 lorsqu'on le chauffe.
| Chloroformiate de méthyle | |
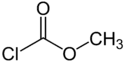 Structure du chloroformiate de méthyle |
|
| Identification | |
|---|---|
| Synonymes |
chlorométhanoate de méthyle, |
| No CAS | |
| No ECHA | 100.001.080 |
| No CE | 201-187-3 |
| PubChem | 6586 |
| SMILES | |
| InChI | |
| Apparence | liquide huileux incolore teinté de jaune à l'odeur piquante |
| Propriétés chimiques | |
| Formule | C2H3ClO2 [Isomères] |
| Masse molaire[1] | 94,497 ± 0,004 g/mol C 25,42 %, H 3,2 %, Cl 37,52 %, O 33,86 %, |
| Propriétés physiques | |
| T° fusion | −61 °C[2] |
| T° ébullition | 72 °C[2] |
| Solubilité | se décompose lentement au contact de l'eau |
| Masse volumique | 1,22 g·cm-3[2] à 20 °C |
| T° d'auto-inflammation | 475 °C[2] |
| Point d’éclair | 10 °C[2] |
| Précautions | |
| SGH[2],[3] | |
   Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le chloroformiate de méthyle est l'ester méthylique de l'acide chloroformique ClCOOH. Il est utilisé en synthèse organique pour introduire des groupes méthoxycarbonyle –COOCH3 sur certains nucléophiles. On l'obtient à partir de phosgène COCl2 et de méthanol CH3OH anhydre :
En faisant ce qu'il faut pour réduire autant que possible la réaction :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Methyl chloroformate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 février 2013 (JavaScript nécessaire)
- Portail de la chimie


