Cobaltocène
Le cobaltocène ou bis(cyclopentadiényl)cobalt(II) est un composé organocobalteux de formule Co(C5H5)2. C'est un solide violet foncé qui se sublime facilement sous vide à température légèrement supérieure que la température ambiante. Le cobaltocène a été découvert peu après le ferrocène, le premier métallocène synthétisé. De par sa forte réactivité avec le dioxygène, le composé doit être manipulé et stocké à l'abri de l'air.
| Cobaltocène | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | cobaltocène bis(η5-cyclopentadiényl)-cobalt |
| Synonymes |
Cp2Co |
| No CAS | |
| No ECHA | 100.013.692 |
| No CE | 215-061-0 |
| No RTECS | GG0350000 |
| SMILES | |
| InChI | |
| Apparence | solide violet foncé |
| Propriétés chimiques | |
| Formule | C10H10Co [Isomères] [Co(η5-C5H5)2] |
| Masse molaire[1] | 189,119 6 ± 0,008 7 g/mol C 63,51 %, H 5,33 %, Co 31,16 %, |
| Propriétés physiques | |
| T° fusion | 176 à 180 °C[2] |
| Précautions | |
| SGH[2] | |
  |
|
| NFPA 704[2] | |
| Écotoxicologie | |
| DL50 | 80mg/kg (souris, intrépéritonéal)[3] 55mg/kg (rat, intrépéritonéal)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure et liaisons
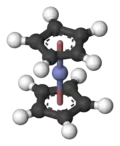
Dans Co(C5H5)2, le cobalt est pris en « sandwich » entre deux cycles cyclopentadiénure (Cp). Les liaisons Co-C ont une longueur d'environ 210 pm (2,1 Å), légèrement plus grandes que les liaisons Fe-C dans le ferrocène[4].
Le cobaltocène possède 19 électrons de valence, un de plus que dans les complexes de métaux de transitions stables (voir la règle des 18 électrons), comme le ferrocène ; cet électron supplémentaire occupe une orbitale antiliante dans le diagramme des OM de ce complexe, ce qui explique d'une part que cette liaison est légèrement plus longue que celle de Fe-C dans le ferrocène et d'autre part que cet électron soit cédé facilement à un oxydant. Beaucoup de réactions impliquant le cobaltocène sont caractérisées par sa tendance à vouloir perdre cet électron supplémentaire, formant le cobaltocénium, un cation à 18 électrons :
2Co(C5H5)2 + I2 → 2[Co(C5H5)2]+ + 2I− 19e−18e−
Un composé analogue du cobaltocène est le rhodocène (le rhodium est juste sous le cobalt dans la classification périodique). Le rhodocène n'existe pas à l'état de monomère car il se dimérise spontanément par formation de liaison C-C entre les cycles Cp.
Synthèse
Le cobaltocène est préparé par réaction entre le cyclopentadiénure de sodium (NaC5H5) et le chlorure de cobalt(II) anhydre dans le THF sec et sous atmosphère inerte.
- 2 NaC5H5 + CoCl2 → Co[C5H5]2 + 2 NaCl
Du chlorure de sodium se forme pendant la réaction. Il est éliminé par extraction du cobaltocène dans un solvant dans lequel NaCl n'est pas soluble (pentane par exemple) et peut être purifié par sublimation sous vide[5].
Réactions
Propriétés oxydoréductrices
Le cobaltocène est un réducteur monoélectronique commun en laboratoire[6]. En réalité, la réversibilité oxydoréductrice pour le couple Co(C5H5)2+/Co(C5H5)2 est tellement bonne que Co(C5H5)2 peut être utilisé en voltampérométrie cyclique comme standard interne (en). Son analogue perméthylé, le décaméthylcobaltocène (Co(C5Me5)2), est un agent réducteur particulièrement fort car la forte densité électronique résultant des dix groupes méthyles facilite le transfert de l'électron supplémentaire porté par le cobalt; ces deux composés sont de bons exemples de réducteurs solubles en solvant organique apolaires. Le tableau ci-dessous donne leur potentiel d'oxydo-réduction avec le couple ferrocène/ferrocénium comme référence :
| Demi-réaction | E° (V) |
|---|---|
| Fe(C5H5)2+ + e− = Fe(C5H5)2 | 0 (par définition) |
| Fe(C5Me5)2+ + e− = Fe(C5Me5)2 | −0,59 |
| Co(C5H5)2+ + e− = Co(C5H5)2 | −1,33 |
| Co(C5Me5)2+ e− = Co(C5Me5)2 | −1,94 |
Les données ci-dessus montrent que les composés bispentamétylcyclopentadiényles sont environ 600 mV plus réducteurs que leur métallocène parent. L'effet du ligand est toutefois moins fort que celui du métal ; changer le fer par le cobalt rend la réduction plus favorable de plus d'1,3 V.
Carbonylation
Le traitement du cobaltocène par le monoxyde de carbone donne un dérivé de cobalt(I), le Co(C5H5)(CO)2, où le cobalt ayant perdu un cycle Cp, se lie à deux ligands CO[5]. La structure géométrique d'un tel complexe est dite en tabouret de piano.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Bis(cyclopentadienyl)cobalt(II), consultée le 21 octobre 2012.
- Progress Report for Contract No. PH-43-64-886, Submitted to the National Cancer Institute by The Institute of Chemical Biology, University of San Francisco. Vol. PH43-64-886
- M. Yu. Antipin, R. Boese, N. Augart, G. Schmid "Redetermination of the cobaltocene crystal structure at 100 K and 297 K: Comparison with ferrocene and nickelocene" Structural Chemistry 1993, Volume 4, Number 2, 91-101. DOI:10.1007/BF00677370
- King, R. B. “Organometallic Syntheses” Volume 1: Academic Press: New York, 1965.
- (en) N. G. Connelly, W. E. Geiger, « Chemical Redox Agents for Organometallic Chemistry », Chem. Rev., vol. 96, no 2, , p. 877–910 (PMID 11848774, DOI 10.1021/cr940053x)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cobaltocene » (voir la liste des auteurs).
