Coenzyme
Les coenzymes (nom masculin ou féminin[1]) sont des molécules organiques particulières, pouvant inclure des ions métalliques, ayant pour spécificité de servir de cofacteurs dans certaines enzymes, en participant obligatoirement à la réaction catalytique. Deux types de coenzymes peuvent être distingués : ceux qui sont structurellement liés par une liaison covalente à l'enzyme au sein d'un complexe stable et qu'on qualifie de groupements prosthétiques, et ceux qui se lient de manière transitoire à l'enzyme et participent au cycle catalytique.
Dans le cas des premiers qui forment des complexes stables, le coenzyme fait partie intégrante de l'enzyme, la partie purement protéique est appelée apoenzyme ; tandis que la protéine associée à son ou ses coenzyme(s) est appelée holoenzyme. La spécificité réactionnelle est apportée par l'holoenzyme.
Les coenzymes sont impliqués directement dans la catalyse, par exemple :
- comme substrats particuliers (cosubstrats) comme des coenzymes rédox (NAD, FAD, groupements héminiques, etc.), l'ATP ;
- comme activateurs de substrats (coenzyme A, biotine…) ;
- comme partie du site actif catalytique (thiamine pyrophosphate, pyridoxal-phosphate…).
Cette classification est contestable mais repose sur les fonctions (qui peuvent être regroupées autrement) et non sur la distinction groupement prosthétique/coenzyme libre. NAD est libre, FAD est lié mais les deux coenzymes ont le même rôle de transfert d'électrons et d'ions H+.
Autre possibilité de classement :
- des coenzymes rédox (qui existent donc sous deux formes, réduite et oxydée) ;
- des coenzymes de transfert de groupements ;
- des coenzymes activateurs de substrats (qui peuvent être classés aussi dans les précédents).
Caractéristiques
Définition
Une définition possible de coenzyme :
- molécule non protéique de faible masse molaire ;
- strictement indispensable à l'activité enzymatique considérée mais non responsable de la stéréospécificité et de l'orientation de la réaction ;
- de concentration cellulaire faible et donc toujours régénérée en fin de réaction par la réaction elle-même ou une autre réaction cellulaire ;
- incluant éventuellement un ion métallique participant à la réaction (fer II ou III, cobalt…) ou d'autres éléments (soufre…). Dans certains cas, des ions métalliques participent par chélation (ex. : ions Mg2+ dans l'ATP).
Origine et biosynthèse
Les coenzymes sont indispensables à l'activité de l'enzyme. Ces composés organiques peuvent être :
- soit synthétisés par la cellule utilisatrice, au travers d'une voie de biosynthèse spécifique, le plus souvent complexe, pour des êtres vivants autotrophes ;
- soit obtenus, pour des êtres vivants incapables de les synthétiser, à partir de précurseurs dans le milieu pour certains cofacteurs chez les organismes auxotrophes. Pour les animaux supérieurs, ces cofacteurs ou leurs précurseurs sont des vitamines. Par exemple, chez l'homme, le phosphate de pyridoxal qui est le coenzyme de nombreuses décarboxylases et des aminotransférases (transaminases) est dérivé de la pyridoxine (vitamine B6). En revanche, notre organisme est capable de synthétiser les porphyrines, constituantes de l'hème présent dans l'hémoglobine et les cytochromes.
Les organismes autotrophes (plantes, nombreux procaryotes) synthétisent tous les coenzymes nécessaires à leur métabolisme.
Participation à la catalyse
Il existe quelques dizaines de coenzymes connus, pour plusieurs milliers d'enzymes : la spécificité de la réaction dépend uniquement de l'apoenzyme et non du coenzyme. Les coenzymes substrats sont régénérés et retournent à leur état initial, soit au cours du cycle catalytique de l'enzyme lui-même, soit lors d'une seconde réaction enzymatique.
Dans leur structure chimique, les coenzymes sont souvent riches en électrons π (par un ou plusieurs noyaux cycliques) qui contribuent à leur fonction dans le cycle catalytique de l'enzyme. Ils réagissent stœchiométriquement (mole à mole) dans la réaction enzymatique.
Types
Les coenzymes ont des rôles variés. Il est possible de distinguer les coenzymes par leur rapport structural avec l'apooenzyme mais cette approche se heurte aux rôles de ces coenzymes.
Première approche
- Comme substrats particuliers (cosubstrats) comme des coenzymes rédox (NAD, FAD, groupements héminiques, etc.), l'ATP. L'enzyme utilise le coenzyme qui sera régénéré dans une autre réaction inverse (le NAD transformé en NADH est régénéré par la chaine respiratoire par exemple), l'ATP est produit par une réaction très exergonique ou par l'ATP synthase liée à la chaine respiratoire.
- Comme activateurs de substrats (coenzyme A, biotine…) permettant le transfert sur un substrat d'autres molécules comme le CO2 (biotine) ou permettant au substrat activé des réactions sinon difficiles (coenzyme A dans l'acétyi-CoA…).
- Comme partie du site actif catalytique (thiamine pyrophosphate, pyridoxal-phosphate…) : le coenzyme réalise la réaction, l'holoenzyme assurant la spécificité.
Deuxième approche
- Des coenzymes rédox (qui existent donc sous deux formes, réduite et oxydée) : ces coenzymes transfèrent des électrons (et éventuellement des protons) à partir d'un substrat pour les placer sur un autre substrat (ex. : production de NADH dans la glycolyse puis consommation du NADH dans la fermentation lactique ou dans la chaine respiratoire). Ce sont le plus souvent des cosubstrats.
- Des coenzymes de transfert de groupements comme le phosphate (ATP), le CO2 (biotine), un groupement 2-oxo (thiamine pyrophosphate).
- Des coenzymes activateurs de substrats (qui peuvent être classés aussi dans les précédents).
Classer est parfois difficile : des transferts de groupements sont parfois liés à des réactions rédox intermédiaires (voir cobalamine dans la méthyl-malonyl mutase par exemple dans Wikipedia en anglais).
Classification

Coenzymes d'oxydoréduction :
- nicotinamide adénine dinucléotide (NAD+/NADH, H+) ;
- nicotinamide adénine dinucléotide phosphate (NADP+/NADPH, H+) ;
- flavine mononucléotide (FMN/FMNH2) ;
- flavine adénine dinucléotide (FAD/FADH2) ;
- coenzyme Q (CoQ/CoQH2) ;
- cytochromes (Cyt[Fe3+]/Cyt[Fe2+]) ;
- glutathion ;
- acide ascorbique (vitamine C) ;
- acide lipoïque ou lipoate ;
- cluster fer-soufre.
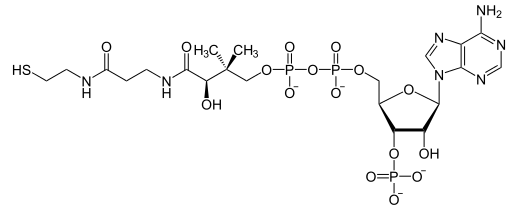
Coenzymes de transfert de groupements :
- adénosine triphosphate (ATP/ADP/AMP) ;
- cytidine triphosphate (CTP/CDP/CMP) ;
- guanosine triphosphate (GTP/GDP/GMP) ;
- thymidine triphosphate (TTP/TDP/TMP) ;
- uridine triphosphate (UTP/UDP/UMP) ;
- coenzyme A (CoA-SH) ;
- thiamine pyrophosphate (TPP) ;
- pyridoxal phosphate (PALP) ;
- biotine (vitamine B8) ;
- 3'-phosphoadénosine 5'-phosphosulfate (PAPS) ;
- S-adénosylméthionine (SAM) ;
- cobalamine (coenzyme B12) ;
Coenzymes d'activation : cette catégorie rassemble certaines des coenzymes précédemment citées, comme le coenzyme A.
Voir aussi
Notes et références
- Portail de la biochimie