Pyrophosphate de thiamine
Le Pyrophosphate de thiamine ou (en) thiamine pyrophosphate (TPP) ou diphosphate de thiamine ou (en) thiamine diphosphate (ThDP), est un dérivé de la vitamine B1, ou thiamine, qui se forme sous l'action d'une enzyme, la thiamine diphosphokinase. C'est un cofacteur présent chez tous les êtres vivants pour y catalyser plusieurs réactions biochimiques.
| Thiamine pyrophosphate | |
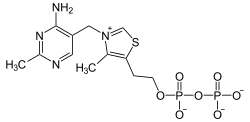
| |
| Structure du pyrophosphate de thiamine (le contranion n'est pas représenté) |
|
| Identification | |
|---|---|
| Nom UICPA | 3-[(4-amino-2-méthylpyrimidin-5-yl)méthyl]-5-[2-(diphosphooxy)éthyl]-4-méthyl-1,3-thiazol-3-ium |
| Synonymes |
cocarboxylase |
| No CAS | (cation) (chlorure) |
| No ECHA | 100.005.307 |
| No CE | 205-836-1 |
| PubChem | 1132 (cation) 9068 (chlorure) |
| ChEBI | 9532 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C12H19N4O7P2S |
| Masse molaire[1] | 425,314 ± 0,019 g/mol C 33,89 %, H 4,5 %, N 13,17 %, O 26,33 %, P 14,57 %, S 7,54 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La biosynthèse du TPP se déroule dans le cytosol. Dans ce dernier, le pyrophosphate de thiamine est nécessaire à l'activité de la transcétolase et, dans les mitochondries, à l'activité de la pyruvate déshydrogénase, de l'α-cétoglutarate déshydrogénase et de la 3-méthyl-2-oxobutanoate déshydrogénase. Le transport mitochondrial du TPP et du monophosphate de thiamine (ThMP) est réalisé par des protéines spécifiques telles que le transporteur de TPP de la levure[2] Tpc1p, le transporteur de TPP humain[3] Tpc et celui de Drosophila melanogaster[4].
Le TPP a été découvert chez l'homme à travers le béribéri, maladie du système nerveux périphérique résultant d'une carence nutritionnelle en vitamine B1[5]. Il intervient comme groupe prosthétique de nombreuses enzymes, telles que :
- la pyruvate déshydrogénase, enzyme E1 du complexe pyruvate déshydrogénase ;
- la pyruvate décarboxylase, enzyme de la fermentation alcoolique ;
- l'α-cétoglutarate déshydrogénase, enzyme E1 du complexe α-cétoglutarate déshydrogénase ;
- la 3-méthyl-2-oxobutanoate déshydrogénase, enzyme E1 du complexe 3-méthyl-2-oxobutanoate déshydrogénase ;
- la 2-hydroxyphytanoyl-CoA lyase ;
- la transcétolase, enzyme de la voie des pentoses phosphates.
Le pyrophosphate de thiamine est l'effecteur de la biosynthèse de la thiamine chez un certain nombre d'organismes pour lesquels ce n'est pas une vitamine, comme les bactéries et les plantes. L'expression des gènes correspondants est réprimée lorsque la concentration de pyrophosphate de thiamine est suffisante. Ce contrôle passe par une régulation de la traduction des ARN messagers, qui implique un riboswitch.
Chimie
Le pyrophosphate de thiamine est constituée d'un cycle pyrimidine lié à un cycle thiazole lié à son tour à un groupe diphosphate. Le thiazole, hétérocycle contenant à la fois un atome d'azote et un atome de soufre, est la partie de la molécule qui est la plus impliquée dans les réactions biochimiques. L'atome de carbone C2 de ce cycle est capable d'agir comme un acide en cédant un proton pour former un carbanion. Les réactions qui donnent des carbanions sont généralement très défavorables d'un point de vue thermodynamique, mais la charge électrique positive de l'atome d'azote tétravalent adjacent au carbanion a pour effet de stabiliser la charge électrique négative de ce dernier en donnant un ylure[5],[6].
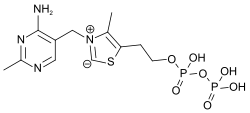
Mode d'action
Voir l'article vitamine B1 avec les commentaires du paragraphe Chimie.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) C.M.T. Marobbio, A. Vozza, M. Harding, F. Bisaccia, F. Palmieri et J.E. Walker, « Identification and reconstitution of the yeast mitochondrial transporter for thiamine pyrophosphate », The EMBO Journal, vol. 21, no 21, , p. 5653-5661 (PMID 12411483, PMCID 131080, DOI 10.1093/emboj/cdf583, lire en ligne)
- (en) Marjorie J. Lindhurst, Giuseppe Fiermonte, Shiwei Song, Eduard Struys, Francesco De Leonardis, Pamela L. Schwartzberg, Amy Chen, Alessandra Castegna, Nanda Verhoeven, Christopher K. Mathews, Ferdinando Palmieri et Leslie G. Biesecker, « Knockout of Slc25a19 causes mitochondrial thiamine pyrophosphate depletion, embryonic lethality, CNS malformations, and anemia », Proceedings of the National Academy of Sciences of the United States of America, vol. 103, no 43, , p. 15927-15932 (PMID 17035501, PMCID 1595310, DOI 10.1073/pnas.0607661103, lire en ligne)
- (en) Domenico Iacopetta, Chiara Carrisi, Giuseppina De Filippis, Valeria M. Calcagnile, Anna R. Cappello, Adele Chimento, Rosita Curcio, Antonella Santoro, Angelo Vozza, Vincenza Dolce, Ferdinando Palmieri et Loredana Capobianco, « The biochemical properties of the mitochondrial thiamine pyrophosphate carrier from Drosophila melanogaster », The FEBS Journal, vol. 277, no 5, , p. 1172-81 (PMID 20121944, DOI 10.1111/j.1742-4658.2009.07550.x, lire en ligne)
- (en) Donald L. Pavia, Gary M. Lampman, George S. Kritz et Randall G. Engel, Introduction to Organic Laboratory Techniques, 4e éd., Thomson Brooks/Cole, 2006, p. 304–305. (ISBN 978-0-495-28069-9)
- (en) Donald Voet, Judith Voet et Charlotte Pratt, Fundamentals of Biochemistry, John Wiley & Sons, 2008, p. 508. (ISBN 978-0-470-12930-2)
- Portail de la biologie
- Portail de la biochimie
- Portail de la chimie