alpha-Cétoglutarate déshydrogénase
L’α-cétoglutarate déshydrogénase, ou 2-oxoglutarate déshydrogénase (OGDH), est une oxydoréductase qui fait partie du complexe alpha-cétoglutarate déshydrogénase, dont elle est l'enzyme E1, complexe qui réalise la conversion de l'α-cétoglutarate en succinyl-CoA et CO2 :
 |
+ CoA-SH + NAD+ → NADH + H+ + CO2 + | |
| α-cétoglutarate | Succinyl-CoA |
| Oxoglutarate déshydrogénase | ||
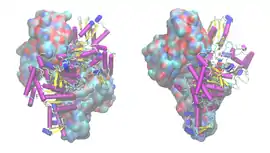 Structure d'une α-cétoglutarate déshydrogénase d'E. coli (PDB 2JGD[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | OGDH | |
| N° EC | 1.2.4.2 | |
| Homo sapiens | ||
| Locus | 7p13 | |
| Masse moléculaire | 115 935 Da[2] | |
| Nombre de résidus | 1 023 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
2-Oxoglutarate déshydrogénase
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | TPP |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Plus précisément, l'enzyme E1 catalyse la fixation de l'α-cétoglutarate sur un lipoamide avec l'aide de thiamine pyrophosphate (TPP).
Le mécanisme de cette réaction, qui fait intervenir successivement les enzymes E1, E2 et E3, chacune avec ses cofacteurs, est assez complexe, et peut être résumé par le schéma simplifié ci-dessous :
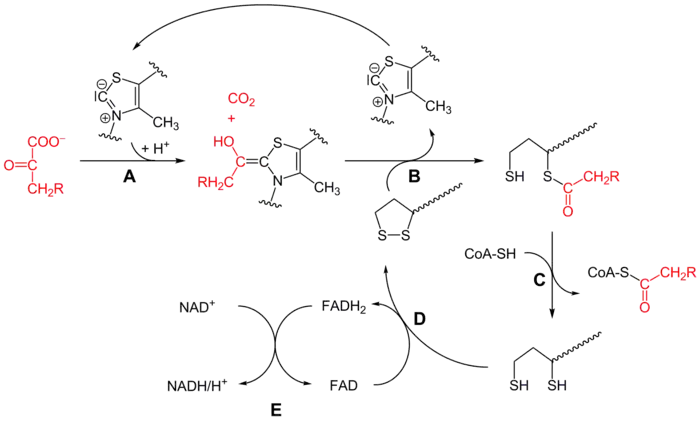 Mécanisme réactionnel du complexe α-cétoglutarate déshydrogénase (R = CH2-COO− sur ce schéma) :
Mécanisme réactionnel du complexe α-cétoglutarate déshydrogénase (R = CH2-COO− sur ce schéma) :
- l’α-cétoglutarate déshydrogénase (E1) catalyse les étapes A et B avec la thiamine pyrophosphate (TPP),
- la dihydrolipoamide S-succinyltransférase (E2) catalyse l'étape C avec le lipoamide et la coenzyme A (CoA-SH),
- la dihydrolipoyl déshydrogénase (E3) catalyse les étapes D et E avec la FAD et la NAD+.
Notes et références
- (en) René A. W. Frank, Amanda J. Price, Fred D. Northrop, Richard N. Perham et Ben F. Luisi, « Crystal Structure of the E1 Component of the Escherichia coli 2-Oxoglutarate Dehydrogenase Multienzyme Complex », Journal of Molecular Biology, vol. 368, no 3, , p. 639-651 (PMID 17367808, DOI 10.1016/j.jmb.2007.01.080, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
Articles connexes
- Pyruvate déshydrogénase, enzyme E1 du complexe pyruvate déshydrogénase
- 3-méthyl-2-oxobutanoate déshydrogénase, enzyme E1 du complexe 3-méthyl-2-oxobutanoate déshydrogénase
- Portail de la biochimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.