Coenzyme Q-cytochrome c réductase
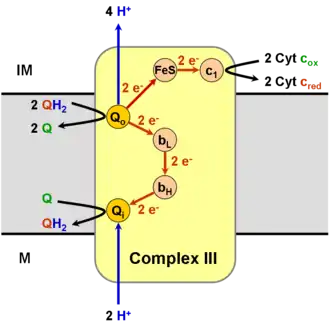
La coenzyme Q-cytochrome c réductase, ou complexe III de la chaîne respiratoire, également appelée complexe bc1, est une oxydoréductase membranaire qui catalyse la réaction :
- ubiquinol + 2 ferricytochrome c + 2 H+matriciel ubiquinone + 2 ferrocytochrome c + 4 H+intermembranaire.
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
| Pfam | PF02921 |
|---|---|
| Clan Pfam | IPR004192 |
| SCOP | 1be3 |
| SUPERFAMILY | 1be3 |
| TCDB | 3.D.3 |
| Famille OPM | 345 |
| Protéine OPM | 3cx5 |
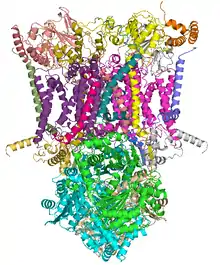
Cette enzyme est présente dans la membrane plasmique de la plupart de bactéries et dans la membrane mitochondriale interne de tous les eucaryotes aérobies.
Structure et fonctionnement
Le complexe III rassemble plusieurs protéines : un cytochrome c1, deux cytochromes b, et une ferrédoxine de type Rieske. L'enzyme elle-même d'un nombre relativement restreint de sous-unités comparé aux autres enzymes respiratoires : il peut n'y en avoir que trois, mais les animaux supérieurs peuvent en compter onze[2]. Trois de ces sous-unités possèdent des groupes prosthétiques. Le cytochrome b possède deux hèmes, notés bL et bH, tandis que le cytochrome c1 en possède un, noté c1, et que la protéine de Rieske possède deux clusters fer-soufre [2Fe-2S].
Le mécanisme réactionnel du complexe III est appelé cycle Q[3],[4], en référence à l'ubiquinone. Chaque cycle a pour effet de libérer quatre protons dans l'espace intermembranaire mitochondrial mais de n'en absorber que deux issus de la matrice mitochondriale. Ceci contribue à la génération d'un gradient de concentration de protons à travers la membrane mitochondriale interne. Dans le même temps, deux molécules d'ubiquinol sont oxydées en ubiquinone, tandis qu'une molécule d'ubiquinone est réduite en ubiquinol et que deux électrons sont transférés à deux cytochromes c.
Le cycle Q se déroule en deux temps :
- Premier temps :
- Une première molécule d'ubiquinol Q10H2 se lie au site Qo du cytochrome b tandis que de l'ubiquinone CoQ10 se lie au site Qi.
- La molécule d'ubiquinol liée au site Qo cède son premier électron à un cluster fer-soufre, qui le cède à l'hème c1 du cytochrome c1, qui le cède enfin à l'hème d'un ferricytochrome c.
- Parallèlement, cette même molécule d'ubiquinol cède son second électron à l'ion ferreux de l'hème bL du cytochrome b, qui le cède à son tour à l'hème bH, qui le cède enfin à l'ubiquinone liée au site Qi pour former un radical semiquinone Q10• –.
- Ceci a pour effet de libérer deux protons H+ et un ferrocytochrome c dans l'espace intermembranaire mitochondrial ainsi qu'une molécule d'ubiquinone dans la membrane mitochondriale interne, issue de l'oxydation de l'ubiquinol initialement lié au site Qo. Le radical semiquinone, quant à lui, demeure lié au site Qi.
- Second temps :
- Une seconde molécule d'ubiquinol Q10H2 se lie au site Qo du cytochrome b.
- Comme à l'étape précédente, cette molécule d'ubiquinol cède son premier électron à un cluster fer-soufre, qui le cède à l'hème c1 du cytochrome c1, qui le cède enfin à l'hème d'un ferrocytochrome c.
- De même, cette molécule d'ubiquinol cède son second électron à l'ion ferreux de l'hème bL du cytochrome b, qui le cède à son tour à l'hème bH, qui le cède cette fois au radical semiquinone Q10• – issu de la première étape.
- Cette dernière réaction conduit à la formation d'une molécule d'ubiquinol sur le site Qi par absorption de deux protons H+ de la matrice mitochondriale.
- L'ensemble de ces réactions a pour effet de libérer deux protons H+ et un ferrocytochrome c supplémentaires dans l'espace intermembranaire ainsi qu'une molécule d'ubiquinone dans la membrane mitochondriale interne, issue de l'oxydation de l'ubiquinol initialement lié au site Qo, et cette fois une molécule d'ubiquinol issue de la réduction de l'ubiquinone initialement liée au site Qi.
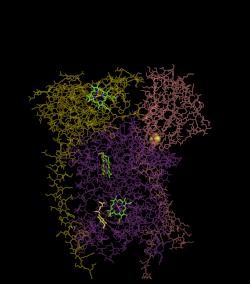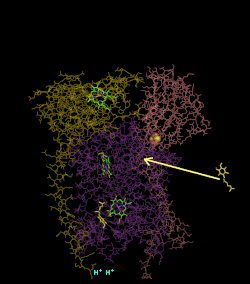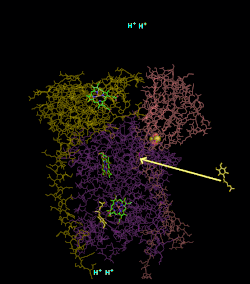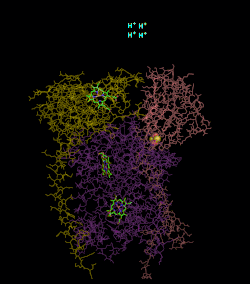
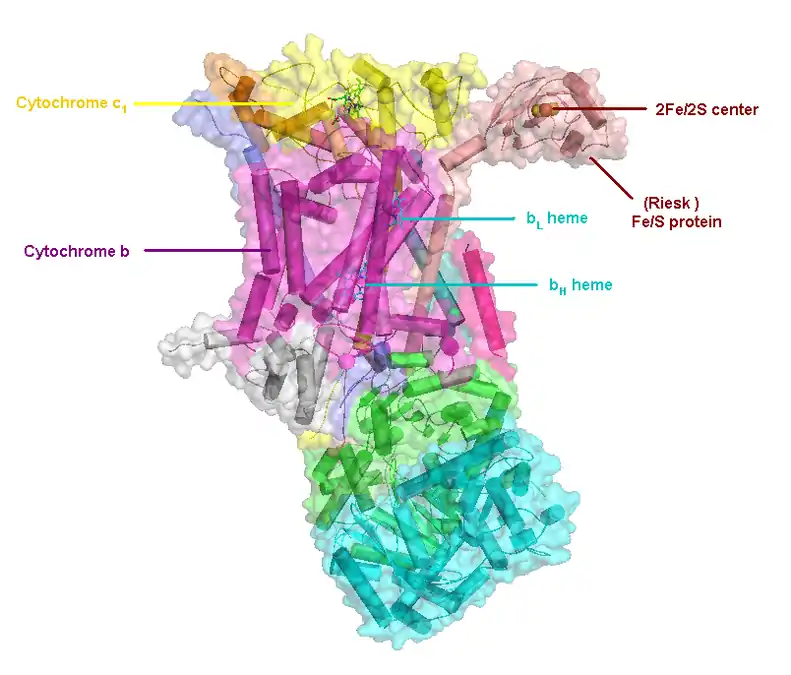 (en) Localisation des protéines et cofacteurs du complexe III : cytochrome c1, cytochrome b, centres fer-soufre, protéine de Rieske, hème bL et hème bH.
(en) Localisation des protéines et cofacteurs du complexe III : cytochrome c1, cytochrome b, centres fer-soufre, protéine de Rieske, hème bL et hème bH.
Inhibiteurs
L'antimycine A est un inhibiteur qui se lie au site Qi du cytochrome b, ce qui bloque la chaîne de transport d'électrons intramoléculaire aboutissant à la réduction de l'ubiquinone du site Qi en ubiquinol.
Le myxothiazole (en) et la stigmatelline (en) sont des inhibiteurs qui se lient au site Qo du cytochrome b, ce qui bloque le transfert des électrons de l'ubiquinol à la protéine de Rieske. Le myxothiazole se lie à proximité du cytochrome bL, d'où le qualificatif d'inhibiteur proximal ; le site de liaison à la stigmatelline est plus éloigné de l'hème bL mais est plus proche de la protéine de Rieske, avec laquelle elle interagit fortement.
Certains de ces inhibiteurs ont été commercialisés comme fongicides (comme les strobilurines, dont la plus connue est l'azoxystrobine, ou comme les quinone outside inhibitors (QoI)) et comme antipaludéens (atovaquone).
Notes et références
- (en) Xiugong Gao, Xiaoling Wen, Lothar Esser, Byron Quinn, Linda Yu, Chang-An Yu et Di Xia, « Structural Basis for the Quinone Reduction in the bc1 Complex: A Comparative Analysis of Crystal Structures of Mitochondrial Cytochrome bc1 with Bound Substrate and Inhibitors at the Qi Site », Buochemistry, vol. 42, no 30, , p. 9067-9080 (PMID 12885240, DOI 10.1021/bi0341814, lire en ligne)
- (en) So Iwata, Joong W. Lee, Kengo Okada, John Kyongwon Lee, Momi Iwata, Bjarne Rasmussen, Thomas A. Link, S. Ramaswamy et Bing K. Jap, « Complete Structure of the 11-Subunit Bovine Mitochondrial Cytochrome bc1 Complex », Science, vol. 281, no 5373, , p. 64-71 (PMID 9651245, DOI 10.1126/science.281.5373.64, lire en ligne)
- (en) David M. Kramer, Arthur G. Roberts, Florian Muller, Jonathan Cape et Michael K. Bowman, « Q-Cycle Bypass Reactions at the Qo Site of the Cytochrome bc1 (and Related) Complexes », Methods in Enzymology, vol. 382, , p. 21-45 (PMID 15047094, DOI 10.1016/S0076-6879(04)82002-0, lire en ligne)
- (en) Antony R. Crofts, « The Cytochrome bc1 Complex: Function in the Context of Structure », Annual Review of Physiology, vol. 66, , p. 689-733 (PMID 14977419, DOI 10.1146/annurev.physiol.66.032102.150251, lire en ligne)
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire