Condensation de Dieckmann
La condensation de Dieckmann est une réaction organique intramoléculaire entre un diester et une base qui donne un β-cétoester cyclique[1],[2],[3],[4],[5],[6],[7]. La réaction est nommée d'après le chimiste allemand Walter Dieckmann (1869–1925). La réaction équivalente intermoléculaire est la condensation de Claisen.
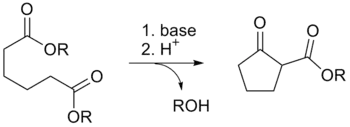 La condensation de Dieckmann
La condensation de Dieckmann
Mécanisme
Tout d'abord, un hydrogène en alpha d'un des groupes ester est arraché par une base forte (de type alcoolate, amidure de sodium, voire hydrure), ce qui forme un dérivé d'énolate. La molécule se cyclise ensuite par substitution nucléophile intramoléculaire, le carbone nucléophile de l'énolate réagissant sur le carbone du groupe ester restant (étape 2), suivi par le départ du groupe alcoolate RO− (étape 3). Toujours en présence d'une base forte, le composé ainsi obtenu se voit arracher son hydrogène acide entre les groupes carbonyle et carboxyle, nécessitant la réaction avec un acide de Brønsted (H3O+ par exemple) pour reformer le β-cétoester[8].
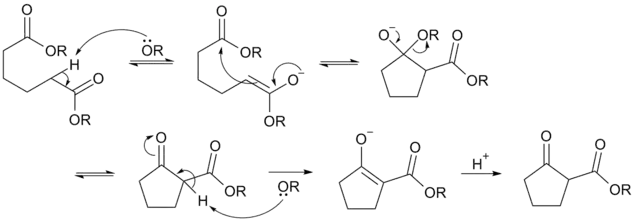 Mécanisme de la condensation de Dieckmann.
Mécanisme de la condensation de Dieckmann.
Du fait de leur stabilité stérique, des cycles à cinq ou six chaînons se forment préférentiellement ; les diesters 1,4 et 1,6 formant généralement des cycles à cinq chaînons, tandis que les diesters 1,5 et 1,7 formeront des cycles à six chaînons[9]. Il est néanmoins possible d'obtenir des cycles jusqu'à huit atomes, voire dans des conditions particulières jusqu'à douze atomes et même des macrocycles.
 |
| animation du mécanisme |
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Dieckmann condensation » (voir la liste des auteurs) et en allemand « Dieckmann-Kondensation » (voir la liste des auteurs).
- (de) W. Dieckmann, « Zur Kenntniss der Ringbildung aus Kohlenstoffketten », Chem. Ber., vol. 27, no 1, , p. 102-103 (ISSN 0009-2940, DOI 10.1002/cber.18940270126).
- (de) W. Dieckmann, « Ueber ein ringförmiges Analogon des Ketipinsäureesters », Chem. Ber., vol. 27, no 1, , p. 965-966 (ISSN 0009-2940, DOI 10.1002/cber.189402701202).
- (de) W. Dieckmann, « Ueber die Nitrosirungsproducte cyclischer β-Ketoncarbonsäureester (Bisnitroso-β-ketoncarbonsäureester und α-Oximidodicarbonsäuren) », Chem. Ber., vol. 33, no 1, , p. 579-595 (ISSN 0009-2940, DOI 10.1002/cber.19000330194).
- (de) W. Dieckmann, « Ueber die Acetessigester-Condensation und ihre Umkehrung », Chem. Ber., vol. 33, no 2, , p. 2670-2684 (ISSN 0009-2940, DOI 10.1002/cber.190003302217).
- (de) W. Dieckmann, « Ueber cyklische β-Ketoncarbonsäureester », Liebigs Ann. Chem., vol. 317, no 1, , p. 27-109 (ISSN 0075-4617, DOI 10.1002/jlac.19013170104).
- (en) J. P. Schaefer et J. J. Bloomfield, Organic Reactions, vol. 15, John Wiley & Sons, , 594 p. (ISBN 978-0-471-17168-3, DOI 10.1002/0471264180.or015.01, présentation en ligne), chap. 2 (« The Dieckmann Condensation (Including the Thorpe-Ziegler Condensation) »).
- Davis, B. R.; Garrett, P. J. Comp. Org. Syn. 1991, 2, 806-829. (Review)
- (en) J. S. Smith, Organic Chemistry, McGraw-Hill, , 2e éd., 1175 p. (ISBN 978-0-07-332749-5, présentation en ligne), p. 932-933
- (en) « Dieckmann Condensation », Organic Chemistry Portal (consulté le ).