Condensation de Knoevenagel
La condensation de Knoevenagel est une réaction de chimie organique dans laquelle un composé carbonylé réagit avec un équivalent de carbanion en présence d'une base faible pour former un composé carbonylé α,β-insaturé ou un composé apparenté après élimination d'une molécule d'eau.
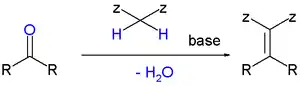
Avec Z un groupe électroattracteur, de type carbonyle, acide carboxylique, nitrile, ester, amide, phosphate, etc.
Historique
En 1894, Emil Knoevenagel découvre que la réaction entre le formaldéhyde et le malonate de diéthyle en présence de diéthylamine mène à la formation de l'adduit bis[1]. En 1896, il réussit à produire de l'acétoacétate d'éthylbenzylidène en faisant réagir du benzaldéhyde avec de l'acétoacétate d'éthyle[1].
Mécanisme
Le mécanisme est différent selon que la base ajoutée est une amine tertiaire d'une part, une amine primaire ou secondaire d'autre part[1].
Mécanisme de Hann-Lapworth
Le mécanisme est similaire à celui d'une condensation aldolique, l'amine tertiaire jouant le rôle de base en captant le proton en alpha des groupes électroattracteurs[1].
Mécanisme avec une amine secondaire ou primaire
Dans ce cas, l'amine réalise une addition nucléophile sur le composé carbonylé, conduisant après élimination d'un ion hydroxyde à un intermédiaire iminium qui est lui-même la cible d'une addition nucléophile menant aux produits[1].
Utilisation
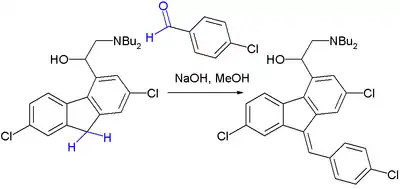
La condensation de Knoevenagel est une étape importante de la synthèse de la luméfantrine, un principe actif anti-malaria qui entre dans la composition du coartem[2].
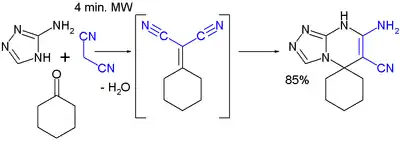
La synthèse du gaz CS comporte également une étape de condensation de Knoevenagel suivie de la réaction de la base avec l'adduit[3].
Variantes
Modification de Doebner
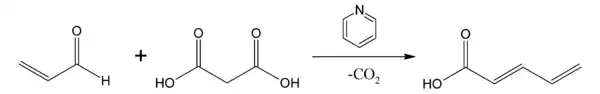
Dans la modification de Doebner[4] de la condensation de Knoevenagel, l'équivalent de carbanion est l'acide malonique. Le produit initial peut alors subir une décarboxylation. La base employée est généralement la pyridine.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Knoevenagel condensation » (voir la liste des auteurs).
- (en) L. Kürti et B. Czakó, Strategic applications of organic named reactions in organic synthesis, Academic Press, , 810 p. (ISBN 978-0-12-429785-2, présentation en ligne), p. 242-243.
- (en) U. Beutler, P. C. Fuenfschilling et al., « An Improved Manufacturing Process for the Antimalaria Drug Coartem. Part II », Org. Process Res. Dev., vol. 11, no 3, , p. 341-345 (ISSN 1083-6160, DOI 10.1021/op060244p).
- (en) A. Dandia, P. Sarawgia et al., « Mild and ecofriendly tandem synthesis of 1,2,4-triazolo[4,3-a]pyrimidines in aqueous medium », ARKIVOC, no 16, , p. 83-92 (ISSN 1551-7004, lire en ligne).
- (de) O. Doebner, « Ueber die der Sorbinsäure homologen, ungesättigten Säuren mit zwei Doppelbindungen », Ber. Dtsch. Chem. Ges., vol. 35, no 1, , p. 1136-1147 (ISSN 0365-9496, DOI 10.1002/cber.190203501187).
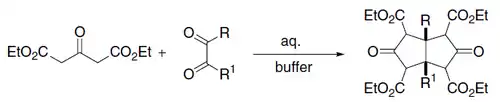
- (en) U. Weiss et J. M. Edwards, « A one-step synthesis of ketonic compounds of the pentalane, [3,3,3]- and [4,3,3]-propellane series », Tetrahedron Lett., vol. 9, no 47, , p. 4885-4887 (ISSN 0040-4039, DOI 10.1016/S0040-4039(00)72784-5).
- Portail de la chimie