Conformation antipériplanaire
En stéréochimie, la conformation antipériplanaire est l'ensemble des conformations particulières, dans lesquelles, pour une molécule A–B–C–D, l'angle dièdre entre la liaison A–B et la liaison C–D est compris entre +150° et −150°[1] (Figures 1 et 2 ). Le terme antipériplanaire est souvent utilisé dans le sens qui correspond à anticoplanaire[2], c'est-à-dire avec un angle angle de liaison A–B–C–D exactement égal à 180° (Figure 3). Dans la projection de Newman, la molécule est en conformation décalée, les groupes fonctionnels antipériplanaires étant dirigés vers le haut et le bas, à 180° l'un de l'autre (voir figure 4). La figure 5 montre le 2-chloro-2,3-diméthylbutane en projection cavalière avec l'atome de chlore antipériplanaire avec un atome d'hydrogène.
Synpériplanaire est semblable à antipériplanaire. Dans le conformère synpériplanaire, A et D sont du même côté du plan de la liaison, l'angle dièdre entre A–B et C–D étant compris entre +30° et −30° (voir figure 2).
 Figure 1 : les groupes fonctionnels A et D sont antipériplanaires. |
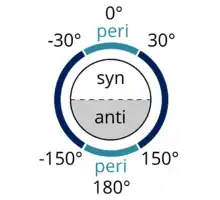 Figure 2 : les groupes fonctionnels sont considérés comme périplanaires s'ils ont un angle dièdre compris entre +150° et −150° ou +30° et −30°. Adapté à partir d'une figure de Dreamtheater, publiée sur Wikimedia Commons. |
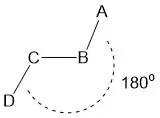 Figure 3 : représentation d'une conformation strictement anticoplanaire. A, B, C et D sont dans le même plan et l'angle dièdre entre A–B et C–D est de 180°. |
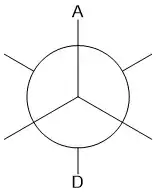 Figure 4 : projection de Newman montrant A et D antipériplanaires. |
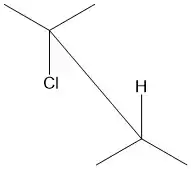 Figure 5 : projection cavalière du 2-chloro-2,3-diméthylbutane montrant Cl et H antipériplanaires. |
Orbitales moléculaires
L'interaction entre les orbitales moléculaires est un facteur important pour expliquer la réactivité en conformation antipériplanaire. Dans la géométrie antipériplanaire, une orbitale liante σ et une orbitale antiliante σ* sont à peu près parallèles entre elles, ou synpériplanaires. La figure 6 est une autre représentation du 2-chloro-2,3-diméthylbutane, qui montre l'orbitale liante σC–H de la liaison C–H, et l'orbitale antiliante σ* C–Cl de la liaison C–Cl, synpériplanaire l'une de l'autre. Les orbitales parallèles peuvent interagir et il se produit un phénomène d'hyperconjugaison. Si l'orbitale liante est un donneur d'électrons et si l'orbitale antiliante est un accepteur d'électrons, l'orbitale liante peut alors induire une électronégativité dans l'orbitale antiliante. Cette interaction donneur-accepteur entre une orbitale occupée et une orbitale vacante a un effet stabilisant global sur la molécule dans la conformation antipériplanaire. Toutefois, cette interaction entre l’une orbitale liante et l'orbitale antiliante a également pour effet d’affaiblir ces deux liaisons. Sur la figure 6, le 2-chloro-2,3-diméthylbutane est stabilisé par hyperconjugaison à partir du don d'électrons provenant de σC–H en σ*C–Cl , mais les deux liaisons C–H et C–Cl sont affaiblies. Un diagramme d'orbitales moléculaires montre que le mélange entre l'orbitale σC–H et l'orbitale σ*C–Cl dans du 2-chloro-2,3-diméthylbutane abaisse l'énergie des deux orbitales (Figure 7).
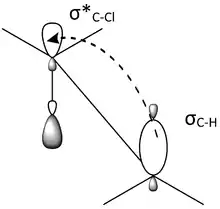 Figure 6 : l’orbitale de la liaison C–H est alignée sur l’orbitale antiliante de C–Cl et il se produit un phénomène d'hyperconjugaison. |
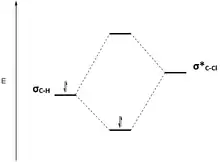 Figure 7 : l’énergie des orbitales liante de C–H et antiliante de C–Cl est plus basse lorsqu’elles se mélangent. |
Exemples de géométrie antipériplanaire dans les mécanismes réactionnels
Mécanisme d'élimination E 2
Une réaction d'élimination bimoléculaire E2se produit dans une molécule où la liaison carbone-hydrogène qui sera rompue et la liaison entre le carbone voisin et le groupe partant sont antipériplanaires[3],[4],[5],[6] (Figure 8). Cette géométrie est préférable car elle aligne les orbitales σC–H et σ*C–X[7],[8]. La figure 9 montre l’orbitale σC-H et l’orbitale σ*C–X parallèles, ce qui permet à l’orbitale σC–H de faire un don dans l’orbite antiliante σ*C–X par hyperconjugaison. Ceci sert à affaiblir les liaisons C–H et C–X, qui sont toutes deux rompues dans une réaction E2. Cela prépare également la molécule pour déplacer plus facilement les électrons σC–H dans une orbitale πC–C (Figure 10).
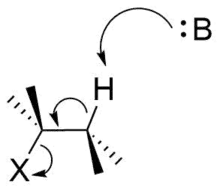 Figure 8 : dans un mécanisme E2 , la rupture de la liaison C–H et de la liaison C–X sont souvent antipériplanaires. Sur la figure, B est une base et X est un groupe partant. |
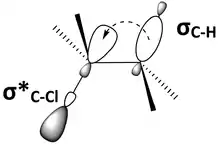 Figure 9 : l’orbitale liante de la liaison C–H se mélange avec l’orbitale antiliante de C–X par hyperconjugaison. |
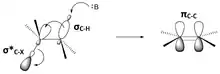 Figure 10 : dans un mécanisme E2, les molécules adoptent généralement une géométrie antipériplanaire, car cela aligne les orbitales moléculaires et prépare la molécule au déplacement des électrons de l'orbitale liante C–H vers l'orbitale liante πC–C. |
Transposition pinacolique
Dans la transposition pinacolique, un groupe méthyle se place en conformation antipériplanaire par rapport à un groupe fonctionnel alcool activé[9],[10]. Cela place l’orbitale liante σC–C du groupe méthyle parallèlement à l’orbitale antiliante σ*C–O de l’alcool activé. Avant que l’alcool activé ne quitte la molécule sous la forme de H2O, l’orbitale liante du groupe méthyle donne à l’orbitale antiliante de la liaison C–O, ce qui affaiblit les deux liaisons. Cette hyperconjugaison facilite le déplacement du groupe méthyle qui se produit pour éliminer l'eau. Voir figure 11 pour le mécanisme.
Histoire, étymologie et mauvais usage
Le terme antipériplanaire a été inventé par William Klyne et Vladimir Prelog dans leur travail intitulé Description des relations stériques à liaisons simples, publié en 1960[11]. « Anti » fait référence aux deux groupes fonctionnels situés de part et d'autre du plan de la liaison. « Péri » vient du mot grec signifiant «près de» et ainsi périplanaire signifie « approximativement planaire »[2]. Dans leur article Périplanaire ou coplanaire ?, Kane et Hersh soulignent que de nombreux manuels de chimie organique utilisent antipériplanaire pour signifier antiplanaire, ou anticoplanaire, ce qui est techniquement incorrect[2].
Voir aussi
- Angle de torsion
- Conformation décalée
- Conformation éclipsée
- Conformation synpériplanaire
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Anti-periplanar » (voir la liste des auteurs).
- (en) Ernest Eliel, Samuel Wilen et Lewis Mander, Stereochemistry of Organic Compounds, New York, Wiley-Scientific, (ISBN 978-0-471-01670-0)
- (en) Kane et Hersh, « Periplanar or Coplanar? », Journal of Chemical Education, vol. 77, no 10, , p. 1366 (DOI 10.1021/ed077p1366)
- (en) Leroy Wade, Organic Chemistry, 8th, , 267–268 p. (ISBN 978-0-321-76841-4)
- (en) Francis Carey et Richard Sundberg, Advanced Organic Chemistry : Part A : Structure and Mechanisms, 5th, , 558–563 p. (ISBN 978-0-387-68346-1)
- (en) Deslongchamps et Deslongchamps, « Bent bonds, the antiperiplanar hypothesis and the theory of resonance. A simple model to understand reactivity in organic chemistry », Organic & Biomolecular Chemistry, vol. 9, no 15, , p. 5321–5333 (PMID 21687842, DOI 10.1039/C1OB05393K, lire en ligne)
- (en) Hunt et Spinney, « Chapter 5: Structure and Preparation of Alkenes. Elimination Reactions » (consulté le )
- (en) Eric Anslyn et Dennis Dougherty, Modern Physical Organic Chemistry, Sausalito (Calif.), University Science, , 590–592 p. (ISBN 978-1-891389-31-3, lire en ligne)
- Rzepa, « An orbtial analysis of the stereochemistry of the E2 elimination reaction », (consulté le )
- (en) Eric Anslyn et Dennis Dougherty, Modern Physical Organic Chemistry, Sausalito (Calif.), University Science, , 676–677 p. (ISBN 978-1-891389-31-3, lire en ligne)
- Francis Carey et Richard Sundberg, Advanced Organic Chemistry : Part B : Reactions and Synthesis, 5th, , 883–886 p. (ISBN 978-0-387-68354-6, lire en ligne)
- (en) Klyne et Prelog, « Description of steric relationships across single bonds », Experientia, vol. 16, no 12, , p. 521–523 (DOI 10.1007/BF02158433)
- Portail de la chimie