Fièvre catarrhale maligne
La fièvre catarrhale maligne est une maladie lymphoproliférative fatale aux bovins causée par un groupe d'herpèsvirus gamma des ruminants du genre Rhadinovirus, notamment des espèces Alcelaphine herpesvirus 1 (AlHV-1)[1] et Ovine Herpes Virus 2 (OHV-2)[2]. Ces virus provoquent une infection inapparente chez leur hôte-réservoir (le mouton pour OvHV-2, le gnou pour AlHV-1), mais sont habituellement fatales aux bovins et à d'autres ongulés comme les cerfs, les antilopes et les buffles[1].

C'est une maladie importante, où le réservoir et les animaux victimes se mélangent. Le problème est particulièrement aigu pour les bovidés de Bali (bantengs), en Indonésie[3], les bisons aux États-Unis[4] et dans les troupeaux nomades de l'est et du sud de l'Afrique[5],[6].
Chez les bovins, la maladie sévit habituellement par poussées sporadiques, bien qu'une infection atteignant 40% d'un troupeau ait été rapportée. Les raisons de ce phénomène sont inconnues. Certaines espèces y semblent plus sensibles, comme le Cerf du père David[7], le banteng[3] et le bison[4], beaucoup de cerfs mourant dans les 48 heures suivant l'apparition des premiers symptômes et les bisons dans les trois jours[8]. Par contraste, les bœufs survivent habituellement une semaine ou plus à leur infection[9].
Épidémiologie
Le terme « fièvre catarrhale maligne » a été appliqué à trois formes de maladie :
- En Afrique, les gnous sont infectés par le virus AlHV-1, mais ne sont pas atteints par la maladie[1]. Le virus est transmis de la mère à sa progéniture et excrété principalement dans les sécrétions nasales des petits gnous de moins d'un an[10],[11]. La maladie est normalement transmise au bétail après la période de mise-bas des gnous. Le bétail de tout âge peut être atteint, avec un taux d'infection plus élevé chez les adultes, particulièrement chez les femelles qui viennent de mettre bas[12]. Le bétail est infecté par contact avec les sécrétions, mais le virus ne se transmet pas d'un animal à l'autre. En l'absence de traitement ou de vaccin, la gestion des troupeaux est la seule méthode de contrôle : il faut éloigner le bétail des gnous pendant la période critique de mise-bas. Cet isolement est bien compris et appliqué notamment par les pasteurs massaïs de Tanzanie et du Kenya[13]. Ceux-ci s'éloignent d'excellent pâturages durant la saison humide, ce qui représente une perte de productivité[14]. Dans l'est et le sud de l'Afrique, la fièvre catarrhale maligne est classée comme un des plus importants problèmes affectant les éleveurs, avec la fièvre de la côte orientale (theilériose bovine), la pleuropneumonie contagieuse bovine, la fièvre aphteuse et l'anthrax[15]. Le bubale roux et le topi peuvent aussi être porteurs de la maladie[16]. Cependant les bubales et les autres antilopes sont infectés par une variante, Alcelaphine herpesvirus 2.
- En Amérique du Nord, des bisons de parcs d'engraissement sans contact avec des moutons ont aussi été diagnostiqués comme atteints d'une forme de fièvre catarrhale maligne. On a récemment découvert que le virus OHV-2 infectait des troupeaux jusqu'à 5 km de l'agneau le plus proche, le nombre d'animaux infectés étant inversement proportionnel à la distance[17].
- Dans le reste du monde, les bœufs et les cerfs contractent la maladie par des contacts rapprochés avec des moutons ou des chèvres durant l'agnelage. Le réservoir naturel de l'Ovine herpesvirus 2 est la sous-famille des Caprinae (moutons et chèvres), et ses victimes appartiennent aux familles des bovidés, cervidés et suidés[18],[19]. La sensibilité au virus OHV-2 varie selon les espèces, les bœufs domestiques et les zébus étant assez résistants, le buffle d'eau et la plupart des cerfs assez sensibles et le bisons, le banteng et le cerf du père David très sensibles[20]. L'ADN du virus OHV-2 a été détecté dans les conduits alimentaires, respiratoires et uro-génitaux du mouton[21], qui peuvent tous être des voies de transmission. Les anticorps des moutons et du bétail pour ce virus s'associent aussi au virus AlHV-1[16].
Les virus AHV-1 et OHV-2 peuvent aussi causer des problèmes dans les zoos, où des hôtes apparemment indemnes (gnous et moutons) et des victimes potentielles sont souvent installés à proximité[22].
La période d’incubation de la fièvre catarrhale maligne n'est pas connue. Le contact intranasal avec le virus AHV-1 a cependant provoqué la maladie d'un pour cent des animaux traités entre 2 semaines et demie et six semaines[23].
Signes cliniques
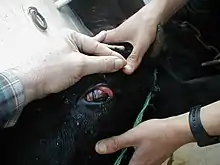
La forme la plus commune de la maladie atteint la tête et l'œil. Les symptômes typiques de cette forme sont la fièvre, la fatigue, des suintements des yeux et des narines, des lésions de la cavité buccale et du museau, le gonflement des ganglions lymphatiques, une opacification de la cornée conduisant à la cécité, le manque d'appétit et la diarrhée. Certains animaux présentent des signes neurologiques comme l'ataxie, un nystagmus pathologique et des poussées au mur (symptôme neurologique). Des manifestations suraiguës, alimentaires et cutanées, ont aussi été décrites[24]. La mort se produit généralement dans les dix jours[25]. Le taux de mortalité des animaux présentant des symptômes est de 90 à 100 %[20]. Le traitement est seulement symptomatique.
Diagnostic
La diagnostic de la fièvre catarrhale maligne repose sur la combinaison de l'historique des animaux, des symptômes, d'histopathologie[24] et de détection dans le sang ou dans les tissus d'anticorps viraux par la méthode immuno-enzymatique ELISA[26],[27] ou de l'ADN viral par réaction en chaîne par polymérase (PCR)[21],[28],[29]. La ressemblance des signes cliniques avec ceux d'autres maladies entériques, par exemple la maladie de la langue bleue, la diarrhée virale bovine et la fièvre aphteuse, rendent les examens de laboratoires importants[30]. L'Organisation mondiale de la santé animale[24] reconnait les examens histopathologiques comme le test diagnostic définitif, mais des laboratoires ont adopté d'autres approches grâce aux récents développements en virologie moléculaire.
Vaccin
Aucun vaccin pour la fièvre catarrhale maligne n'a encore été mis au point. Cela s'avère difficile, car le virus ne se développe pas en culture cellulaire, pour une raison restée longtemps inconnue. Aux États-Unis, des chercheurs de l'Agricultural Research Service (ARS) ont récemment découvert que ce virus subit des modifications dans le corps de l'animal, un phénomène connu sous le nom de « changement de tropisme cellulaire » : le virus a pour cible des cellules différentes à chaque phase de son cycle de vie. Ce phénomène explique pourquoi il est impossible de cultiver le virus sur un seul type de cellules.
Le virus se transmettant des moutons aux bisons et aux bœufs, les chercheurs se sont d'abord concentrés sur son cycle de vie chez le mouton. Ce cycle comporte trois phases : entrée, séjour et libération. Dans une première phase, le virus pénètre des cavités nasales de son hôte jusque dans ses poumons, où il se réplique. Il subit alors un changement de tropisme et infecte des lymphocytes (globules blancs), qui jouent un rôle dans le système immunitaire des moutons. Durant la phase de séjour, le virus reste dans les lymphocytes et circule avec eux dans le corps de l'animal. Finalement, dans la phase de libération, il subit un nouveau changement de tropisme, prenant pour cible des cellules de la cavité nasale, ce qui lui permet de se répandre avec les sécrétions nasales[31]. Cette découverte est un pas important vers l'élaboration d'un vaccin — en commençant par cultiver le virus sur les cellules convenant aux phases de son développement — mais les chercheurs de l'ARS étudient aussi d'autres méthodes pour cela. Ils font notamment des expériences avec le virus de la fièvre catarrhale maligne qui infecte le topi (une antilope africaine) : celui-ci se développe en culture cellulaire et n'infecte pas le bétail. Les chercheurs espèrent qu'en insérant des gènes du virus ovin dans le virus du tofi, ils pourraient produire à terme un vaccin pour les bœufs et le bison[31].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bovine malignant catarrhal fever » (voir la liste des auteurs).
- (en) W. Plowright, R. D. Ferris et G. R. Scott, « Blue Wildebeest and the Ætiological Agent of Bovine Malignant Catarrhal Fever », Nature, no 188, , p. 1167-1169 (DOI 10.1038/1881167a0).
- (en) P. C. Schultheiss, J. K. Collins, T. R. Spraker et J. C. DeMartini, « Epizootic Malignant Catarrhal Fever in Three Bison Herds: Differences from Cattle and Association with Ovine Herpesvirus-2 », J. Vet Diagn Invest., vol. 12, no 6, , p. 497-502 (PMID 11108448).
- (en) A. Wiyono, S. I. Baxter, M. Saepulloh, R. Damayanti, P. Daniels et H. W. Reid, « PCR detection of ovine herpesvirus-2 DNA in Indonesian ruminants — normal sheep and clinical cases of malignant catarrhal fever », Vet. Microbiol., vol. 42, no 1, , p. 45-52 (PMID 7839584).
- (en) J. A. Berezowski, G. D. Appleyard, T. B. Crawford, J. Haigh, H. Li, D. M. Middleton, B. P. O'Connor, K. West et M. Woodbury, « An outbreak of sheep-associated malignant catarrhal fever in bison (Bison bison) after exposure to sheep at a public auction sale », J. Vet. Diagn. Invest., vol. 17, no 1, , p. 55-58 (PMID 15690951).
- (en) S. Cleaveland, L. Kusiluka, J. Ole Kuwai, C. Bell et R. Kazwala, Assessing the impact of Malignant Catarrhal Fever in Ngorongoro District, Tanzania. A study commissioned by the Animal Health Programme, DFID, (lire en ligne [PDF]).
- (en) C. Bedelian, D. Nkedianye et M. Herrero, « Maasai perception of the impact and incidence of malignant catarrhal fever (MCF) in southern Kenya », Prev. Vet. Med., vol. 8, nos 3-4, , p. 296-316 (PMID 17123651).
- (en) H. W. Reid, D. Buxton, W. A. McKelvey, J. A. Milne et W. T. Appleyard, « Malignant catarrhal fever in Pere David's deer », Vet Rec., vol. 121, no 12, , p. 276-277 (DOI 10.1136/vr.121.12.276).
- (en) D. O'Toole, H. Li, C. Sourk, D. L. Montgomery et T. B. Crawford, « Malignant catarrhal fever in a bison feedlot, 1994–2000 », J Vet Diagn Invest., vol. 14, no 3, , p. 183-193 (PMID 12033673).
- (en) A. Holliman, R. Daniel, D. F. Twomey, J. Barnett, S. Scholes, K. Willoughby et G. Russell, « Malignant catarrhal fever in cattle in the UK », Vet Rec., vol. 161, no 14, , p. 494-495 (PMID 17921444).
- (en) E. Z. Mushi et F. R. Rurangirwa, « Malignant catarrhal fever virus shedding by infected cattle », Bull Anim Health Prod Afr., vol. 29, no 1, , p. 111-112 (PMID 7296019).
- (en) S. I. Baxter, A. Wiyono, I. Pow et H. W. Reid, « Identification of ovine herpesvirus-2 infection in sheep », Archives of Virology, vol. 142, , p. 823-831 (PMID 9170507).
- (en) B. J. H. Barnard, J. J. Van der Lugt et E. Z. Mushi, « Malignant Catarrhal Fever », dans J. A. W Coetzer, G. R. Thompson et R. C. Tustin (dir.), Infectious Diseases of Livestock, New York, Oxford University Press, (ISBN 0195705068).
- Serge Morand, François Moutou, Céline Richomme et al. (préf. Jacques Blondel), Faune sauvage, biodiversité et santé, quels défis ?, Quæ, coll. « Enjeux Sciences », , 190 p. (ISBN 978-2-7592-2202-5, lire en ligne), IV. Santé animale et société humaine, chap. 13 (« Comment la santé de la faune sauvage est-elle perçue ? »), p. 140-141, accès libre.
- (en) K. H. Homewood, W. A. Rodgers et K. Arhem, « Ecology of pastoralism in Ngorongoro Conservation Area, Tanzania », J. Agric. Sci. Camb., vol. 108, , p. 47-72 (DOI 10.1017/S0021859600064133).
- (en) R. B. Boone et M. B. Coughenour, A system for integrated management and assessment of east African pastoral lands. Balancing food security, wildlife conservation, and ecosystem integrity, Davis, CA, Global Livestock Collaborative Research Support Program, , 191 p. (lire en ligne).
- (en) Frank J. Fenner et al., Veterinary Virology, San Diego/New York/Boston etc., Academic Press, , 666 p. (ISBN 0-12-253056-X).
- (en) H. Li, G. Karney, D. O'Toole et T. B. Crawford, « Long distance spread of malignant catarrhal fever virus from feedlot lambs to ranch bison », Can Vet J., vol. 49, no 2, , p. 183-185 (lire en ligne).
- (en) N. S. Taus, D. R. Herndon, D. L. Traul, J. P. Stewart, M. Ackermann, H. Li et K. A. Brayton, « Comparison of ovine herpesvirus 2 genomes isolated from domestic sheep (Ovis aries) and a clinically affected cow (Bos bovis) », J Gen Virol., vol. 88 (Pt1), , p. 40-45 (PMID 17170434).
- (en) D. O'Toole, N. S. Taus, D. L. Montgomery, J. L. Oaks, T. B. Crawford et H. Li, « Intra-nasal inoculation of American bison (Bison bison) with ovine herpesvirus-2 (OvHV-2) reliably reproduces malignant catarrhal fever », Vet Pathol., vol. 44, no 5, , p. 655-662 (PMID 17846237).
- (en) « Malignant Catarrhal fever », The Center for Food Security and Public Health at Iowa State University, (consulté le ), p. 9.
- (en) D. Hüssy, N. Stäuber, C. M. Leutenegger, S. Rieder et M. Ackermann, « Quantitative fluorogenic PCR assay for measuring ovine herpesvirus 2 replication in sheep », Clinical and Diagnostic Laboratory Immunology, no 8, , p. 123-128 (DOI 10.1128/CDLI.8.1.123-128.2001).
- (en) A. J. Cooley, N. S. Taus et H. Li, « Development of a management program for a mixed species wildlife park following an occurrence of malignant catarrhal fever », J Zoo Wildl Med., vol. 39, no 3, , p. 380-385 (PMID 18817000).
- (en) D. M. Haig, D. Grant, D. Deane, I. Campbell, J. Thomson, C. Jepson, D. Buxton et G. C. Russell, « An immunisation strategy for the protection of cattle against alcelaphine herpesvirus-1-induced malignant catarrhal fever », Vaccine, vol. 26, no 35, , p. 4461-4468 (DOI 10.1016/j.vaccine.2008.06.056).
- (en) Office international des épizooties, Manual of diagnostic tests and vaccines for terrestrial animals : mammals, birds and bees, Paris, , 5e éd. (ISBN 978-92-9044-622-4), p. 570-579.
- (en) Carter, G.R.; Flores, E.F.; Wise, D.J., « Herpesviridae », A Concise Review of Veterinary Virology, (consulté le ).
- (en) S. J. Fraser, P. F. Nettleton, B. M. Dutia, D. M. Haig et G. C. Russell, « Development of an enzyme-linked immunosorbent assay for the detection of antibodies against malignant catarrhal fever viruses in cattle serum », Vet Microbiol., vol. 116, nos 1-3, , p. 21-28 (PMID 16621342).
- (en) H. Li, T. C. McGuire, U. U. Müller-Doblies et T. B. Crawford, « A simpler, more sensitive competitive inhibition enzyme-linked immunosorbent assay for detection of antibody to malignant catarrhal fever viruses », J Vet Diagn Invest., vol. 13, no 4, , p. 361-364 (PMID 11478614).
- (en) C. W. Cunha, L. Otto, N. S. Taus, D. P. Knowles et H. Li, « Development of a multiplex real-time PCR for detection and differentiation of malignant catarrhal fever viruses in clinical samples », J Clin Microbiol., vol. 47, no 8, , p. 2586-2589 (DOI 10.1128/JCM.00997-09).
- (en) D. L. Traul, N. S. Taus, J. Lindsay Oaks, D. O'Toole, F. R. Rurangirwa, T. V. Baszler et H. Li, « Validation of nonnested and real-time PCR for diagnosis of sheep-associated malignant catarrhal fever in clinical samples », J Vet Diagn Invest, vol. 19, no 4, , p. 405-408 (PMID 17609352).
- (en) R. Bexiga, H. Guyot, C. Saegerman, A. Mauroy, F. Rollin, E. Thiry, A. W. Philbey, D. N. Logue, D. J. Mellor, D. C. Barrett et K. Ellis, « Clinical differentiation of malignant catarrhal fever, mucosal disease and bluetongue », Vet Rec., vol. 161, no 25, , p. 858-859 (PMID 18156595).
- (en) Hong Li et Lynn Herrmann-Hoesing, « Figuring Out Puzzling Animal Diseases », Agricultural Research, US Department of Agriculture, (lire en ligne, consulté le ).
Liens externes
- Portail de l’élevage
- Portail de la virologie
- Portail de la médecine vétérinaire