Cyclohexanol
Le cyclohexanol est un composé organique alcoolique de formule brute C6H12O. Cette molécule se présente sous forme d'un solide hygroscopique incolore qui, quand il est très pur, fond à température ambiante. Des millions de tonnes sont produites industriellement chaque année, notamment pour servir de précurseur au nylon[11] par le biais de l'acide adipique. Sa constante molale cryoscopique a une valeur de 42,2 °C∙kg/mol et sa constante molale ébullioscopique a une valeur de 3,5 °C∙kg/mol.
| Cyclohexanol | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Cyclohexanol | |
| Synonymes |
Alcool cyclohexylique |
|
| No CAS | ||
| No ECHA | 100.003.301 | |
| No CE | 203-630-6 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide hygroscopique incolore ou cristaux blancs, d'odeur caractéristique[1]. | |
| Propriétés chimiques | ||
| Formule | C6H12O [Isomères] |
|
| Masse molaire[2] | 100,158 9 ± 0,005 9 g/mol C 71,95 %, H 12,08 %, O 15,97 %, |
|
| Propriétés physiques | ||
| T° fusion | 23 °C[1] | |
| T° ébullition | 161 °C[1] | |
| Solubilité | dans l'eau à 20 °C : 40 g·l-1[1] | |
| Paramètre de solubilité δ | 23,3 MPa1/2 (25 °C)[3] | |
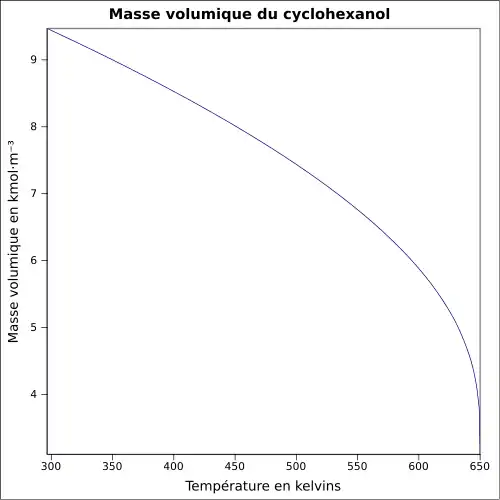
| Masse volumique | 0,962 4 g·cm-3 [4]
|
|
| T° d'auto-inflammation | 300 °C[1] | |
| Point d’éclair | 68 °C (coupelle fermée)[1] | |
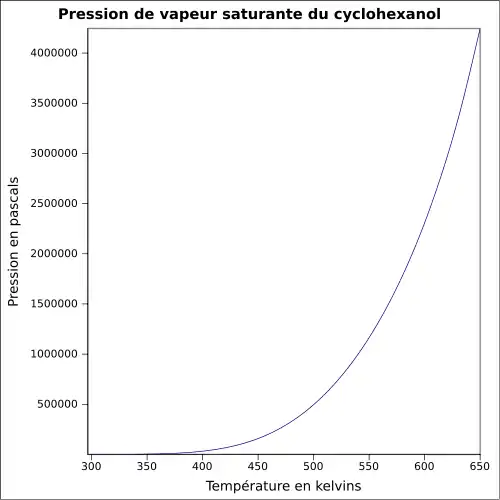
| Pression de vapeur saturante | à 20 °C : 0,13 kPa[1]
|
|
| Point critique | 37,5 bar, 351,85 °C [6] | |
| Thermochimie | ||
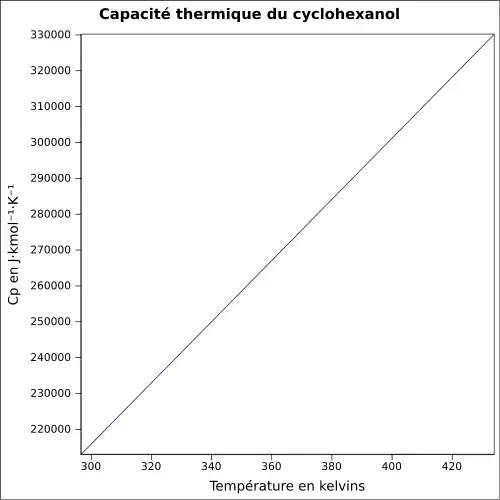
| Cp | ||
| Propriétés optiques | ||
| Indice de réfraction | 1,465 6 [4] | |
| Précautions | ||
| SGH[8] | ||
 Attention |
||
| SIMDUT[9] | ||
  B3, D2B, |
||
| NFPA 704 | ||
| Écotoxicologie | ||
| Seuil de l’odorat | bas : 0,05 ppm haut : 0,15 ppm[10] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Production
Le cyclohexanol est produit par oxydation du cyclohexane dans l'air le plus souvent en présence de cobalt[11] en quantité catalytique.

Cette réaction forme un mélange de cyclohexanol et de cyclohexanone notamment utilisé lors de la synthèse de l'acide adipique. Cette oxydation implique des radicaux libres et un passage par un intermédiaire réactionnel hydroperoxyde. Une autre voie de synthèse consiste en l'hydrogénation du phénol
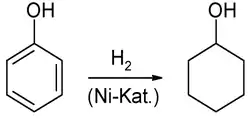
Réactions de bases
Le cyclohexanol possède le même type de réactivité que la plupart des alcools secondaires. Son oxydation conduit à la cyclohexanone, convertit à grande échelle en son oxime qui fournit le caprolactame lors d'un réarrangement de Beckmann.

L'esterification du cyclohexanol conduit à des dérivés utilisés commercialement en tant que plastifiants. Il permet également de synthétiser le cyclohexene quand il est chauffé en milieu acide.
Références
- CYCLOHEXANOL, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic compounds C5 to C7, vol. 2, Huston, Texas, Gulf Pub. Co., , 400 p. (ISBN 0-88415-858-6)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Alcool cyclohexylique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Cyclohexanol », sur hazmap.nlm.nih.gov (consulté le )
- Michael Tuttle Musser "Cyclohexanol and Cyclohexanone" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.