Cyclopropanol
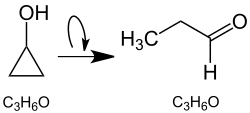
Le cyclopropanol est un composé organique qui consiste en un cycle cyclopropanique substitué par un groupe hydroxyle. Il s'agit donc d'un alcool cyclique. Ce composé est instable en raison du cycle à trois chaînons très tendu et subit rapidement des réactions d'ouverture du cycle. Le cyclopropanol se réarrange (s'isomérise) principalement en propanal[5],[6] :
| Cyclopropanol | |||
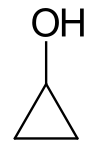
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | cyclopropanol | ||
| Synonymes |
alcool cyclopropylique, hydroxycyclopropane |
||
| No CAS | |||
| No ECHA | 100.217.724 | ||
| PubChem | 123361 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide[1] | ||
| Propriétés chimiques | |||
| Formule | C3H6O [Isomères] |
||
| Masse molaire[2] | 58,079 1 ± 0,003 1 g/mol C 62,04 %, H 10,41 %, O 27,55 %, |
||
| Propriétés physiques | |||
| T° ébullition | 101 à 102 °C[3] | ||
| Masse volumique | 0,917 g·cm-3[4] | ||
| Précautions | |||
| SGH[1] | |||
  |
|||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le cyclopropanol peut être obtenu par une réaction du bromure d'éthylmagnésium avec l'épichlorhydrine[7]. Des dérivés peuvent être obtenus via une réaction de Kulinkovich[8]. Enfin une biosynthèse à partir de cyclopropane[9] ainsi que d'autres voies de synthèse[10] sont connues.
Du fait de sa facilité d'ouverture du cycle, le cyclopropanol peut être utilisé comme synthon pour l'énolate de propanal. C'est aussi un réactif de choix pour insérer un groupe cyclopropyle dans des esters, des sulfates, des amines, etc. Les composés cyclopropaniques résultant ont été testés comme médicaments antiviraux potentiels[11] et comme modulateurs du transport de protéines[12].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Cyclopropanol » (voir la liste des auteurs) et en allemand « Cyclopropanol » (voir la liste des auteurs).
- [PDF] (en) Fluorochem, Safety Data Sheet
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- J. A. Jongejan, J. A. Duine, Enzymatic hydrolysis of cyclopropyl acetate. A facile method for medium- and large-scale preparations of cyclopropanol, Tetrahedron Lett., 1987, vol. 28(24), p. 2767–2768, DOI:10.1016/S0040-4039(00)96204-X.
- J. D. Roberts, V. C. Chambers, Small-Ring Compounds. VI. Cyclopropanol, Cyclopropyl Bromide and Cyclopropylamine, J. Am. Chem. Soc., 1951, vol. 73(7), p. 3176–3179, DOI:10.1021/ja01151a05.
- J. K. Magrane, D. L. Cottle, The Reaction of Epichlorohydrin with the Grignard Reagent., J. Am. Chem. Soc., 1942, vol. 64, p. 484, DOI:10.1021/ja01255a004.
- Glenn W. Stahl, D. L. Cottle, The Reaction of Epichlorohydrin with the Grignard Reagent. Some Derivatives of Cyclopropanol., J. Am. Chem. Soc., 1943, vol. 65, p. 1782, DOI:10.1021/ja01249a507.
- John D. Roberts, Vaughan C. Chambers, Small-Ring Compounds. VI. Cyclopropanol, Cyclopropyl Bromide and Cyclopropylamine., J. Am. Chem. Soc., 1951, vol. 73, p. 3176, DOI:10.1021/ja01151a053.
- John J. Eisch, Adetenu A. Adeosun, John N. Gitua, Mechanism of the Kulinkovich Cyclopropanol Synthesis: Transfer-Epititanation of the Alkene in Generating the Key Titanacyclopropane Intermediate, Eur. J. Org. Chem., 2003, vol. 2003, p. 4721, DOI:10.1002/ejoc.200300588.
- J. Salaün, M.S. Baird, Biologicaliy Active Cyclopropanes and Cyclopropenes, Curr. Med. Chem., 1995, vol. 2(1), p. 511–542. sur Google Livres.
- F. J. McQuillin, M. S. Baird, Alicyclic Chemistry, CUP Archive, 1983 (ISBN 978-0-521-28391-5), p. 102, sur Google Livres.
- J. J. Cottell, J. O. Link, S. D. Schroeder, J. Taylor, W. Tse, R. W. Vivian, Z.-Y. Yang, WO application 2009005677: Antiviral compounds, 8 janvier 2009.
- C. E. Bulawa, M. Devit, D. Elbaum, WO application 2009062118: Modulators of protein trafficking, 14 mai 2009.
- (en) « Cyclopropanol », sur NIST/WebBook
- Portail de la chimie