Éther diéthylique
L'éther diéthylique, également appelé éther éthylique ou éthoxyéthane ou diéthyl éther ou oxyde de diéthyle ou tout simplement éther (à ne pas confondre avec la famille des éthers dont il fait partie), est un liquide limpide, incolore et très inflammable avec un point d'ébullition bas et une odeur typique. Le diéthyl éther a pour formule CH3-CH2-O-CH2-CH3. Il est souvent utilisé comme solvant et a été un anesthésique général. Le diéthyl éther a un indice de cétane élevé (85 - 96) ; et il est faiblement soluble dans l'eau.
Pour les articles homonymes, voir Éther.
| Éther diéthylique | |
| Structure chimique du diéthyl éther | |
| Identification | |
|---|---|
| Nom UICPA | éthoxyéthane |
| Synonymes |
diéthyl éther |
| No CAS | |
| No ECHA | 100.000.425 |
| No CE | 200-467-2 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore très volatil, d'odeur caractéristique[1] |
| Propriétés chimiques | |
| Formule | C4H10O [Isomères] |
| Masse molaire[2] | 74,121 6 ± 0,004 2 g/mol C 64,82 %, H 13,6 %, O 21,59 %, |
| Moment dipolaire | 1,098 ± 0,001 D[3] |
| Diamètre moléculaire | 0,529 nm[4] |
| Propriétés physiques | |
| T° fusion | −116 °C[1] |
| T° ébullition | 35 °C[1] 34,6 °C (760 mmHg) |
| Solubilité | 69 g·l-1 (eau, 20 °C)[1], 60,4 g·l-1 (eau, 25 °C) ; miscible avec le benzène, le chloroforme, l'éther de pétrole, la plupart des huiles ; soluble dans le HCl conc., l'acétone ; très soluble dans l'éthanol[5] |
| Paramètre de solubilité δ | 15,1 MPa1/2 (25 °C)[6] |
| Masse volumique | 0,714 g·cm-3 (20 °C)[7]
|
| T° d'auto-inflammation | 160 à 180 °C[1] |
| Point d’éclair | −45 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 1,7–48 %vol[1] |
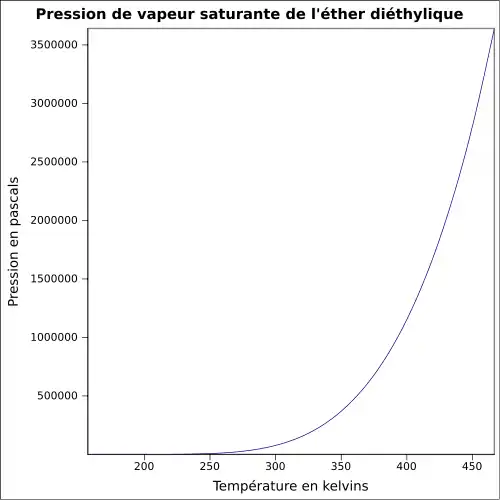
| Pression de vapeur saturante | à 20 °C : 58,6 kPa[1]
|
| Viscosité dynamique | 0,224 mPa·s à 25 °C[9]
|
| Point critique | 36,4 bar, 193,55 °C[10] |
| Point triple | −116,23 °C |
| Vitesse du son | 976 m·s-1 à 25 °C[11] |
| Thermochimie | |
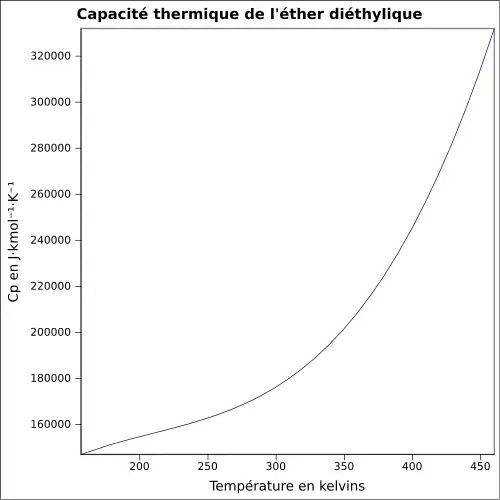
| Cp | |
| PCS | 2 723,9 kJ·mol-1[13] (liquide) |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 9,51 ± 0,03 eV (gaz)[14] |
| Propriétés optiques | |
| Indice de réfraction | 1,3495[4] |
| Spectre d’absorption | λmax=171 nm (log ε= 3,60), 188 nm (log ε= 3,30) (gaz)[5] |
| Précautions | |
| SGH[15] | |
  Danger |
|
| SIMDUT[16] | |
 B2, |
|
| NFPA 704 | |
| Transport | |
| Écotoxicologie | |
| LogP | 0,89[1] |
| Seuil de l’odorat | bas : 0,3 ppm[17] |
| Caractère psychotrope | |
| Catégorie | Dépresseur |
| Mode de consommation |
Inhalation des vapeurs ; ingestion |
| Autres dénominations |
Éther ; Liqueur d'Hoffmann |
| Risque de dépendance | Modéré |
| Unités du SI et CNTP, sauf indication contraire. | |
Historique
La découverte de ce produit est attribuée à l'alchimiste Raymond Lulle en 1275, bien qu'aucune preuve de cette époque ne l'atteste.
Il est synthétisé pour la première fois en 1540 par Valerius Cordus, qui l'appelle l'« huile douce de vitriol » car il le fabriquait par distillation d'un mélange de vitriol (acide sulfurique) et d'« esprit de vin » (éthanol). C'est pour cela qu'il a été appelé « éther sulfurique » pour éviter la confusion avec les autres éthers. Peu de temps après, Theophrastus Bombastus von Hohenheim, plus connu sous le nom de Paracelse, découvre ses propriétés analgésiques.
Frédéric Cuvier[18] attribue la première introduction à l'année 1730, par un chimiste allemand utilisant le pseudonyme de Frobenius. Ce composé est également connu dans l'histoire sous le nom de « liqueur de Frobenius ». Grosse, collaborateur de Duhamel du Monceau, mit au point la technique de distillation de l’alcool en milieu sulfurique et précisa les conditions d’obtention d’un produit pratiquement pur[19].
L'éther diéthylique est listé au tableau II de la Convention contre le trafic illicite de stupéfiants et de substances psychotropes de 1988.
Utilisation
En médecine
L'éther a été longtemps utilisé en tant qu'anesthésique, cependant ses effets secondaires très désagréables, tels que les nausées, et sa toxicité, ainsi que le risque élevé de dépendance, ont fait qu'il n'est plus utilisé en France et dans de nombreux pays développés, où on lui préfère des anesthésiants moins destructeurs. Il peut également être utilisé pour nettoyer les restes de colle d'un pansement adhésif sur la peau.
En chimie
L’éther éthylique est un solvant encore utilisé en laboratoire, car il est un solvant organique peu polaire assez peu coûteux. Il est souvent utilisé comme solvant dans diverses réactions, notamment celles incluant les organométalliques, où celui-ci possède le rôle de stabilisateur. En effet, les doublets présents sur l'oxygène stabilisent la charge positive du métal.
Cependant, son extrême inflammabilité et sa volatilité (cf. plus bas) font qu’on lui préfère un solvant moins dangereux lorsque c'est possible.
Dans l'industrie chimique, il est utilisé pour produire le collodion qui est un des composants de base de la poudre sans fumée, un explosif communément utilisé au début du XXe siècle et en particulier durant les deux guerres mondiales, et est également utilisé pour les munitions de chasse. Il est commercialisé également en aérosol comme aide au démarrage des moteurs thermiques.
En biologie
En biologie, l’éther éthylique, appelé couramment l'« éther », est utilisé pour anesthésier, endormir ou tuer de petits insectes que l'on veut observer (tels que la drosophile) ; on imbibe le feutre d'un étheriseur puis on met le bouchon avant de verser les sujets dans l'entonnoir et on attend que les vapeurs fassent effet.
Toxicologie
L'éther est un toxique primaire dont les effets – en cas d'expositions brèves et non répétées – sont en grande partie réversibles. Associé à d'autres produits, il peut être un cofacteur de toxicité ou un toxique secondaire car, en tant que solvant, il peut aider d'autres toxiques à pénétrer la peau ou les muqueuses, pulmonaires notamment.
La toxicité primaire est due au fait que son principal organe cible est le cerveau[20].
- L'éther y diminue l'amplitude et la fréquence des ondes cérébrales (d'où son effet narcotique et d'anesthésie du système nerveux central). Il agit en réduisant ou bloquant les impulsions du système multisynaptique du cérébral moyen en déprimant les événements corticaux locaux et en coupant les communications entre cortex et diencéphale.
- Dans la moelle épinière, il inhibe les arcs réflexes à deux ou plusieurs neurones.
- Après une excitation initiale, il induit une dépression du système nerveux qui entraîne la mort (paralysie des muscles respiratoires) si l'exposition se prolonge. La DL50 orale est de 1,67 ml·kg-1 (1 210 mg·kg-1 chez le rat adulte. La DL50 cutanée est supérieure à 20 ml·kg-1 chez le lapin (env. 1 430 mg·kg-1). La CL50 (pour trois heures d'exposition) est de 42 000 ppm (127,4 mg·kg-1) chez la souris et de 32 000 ppm (environ 97 mg·l-1) chez le rat (pour quatre heures d'exposition).
L'éther a également d'autres effets[20].
- Il stimule le système (ortho)sympathique en provoquant une tachycardie, une hypertension et une atonie intestinale.
- Il déprime la pression sanguine, ce qui entraîne, en cas d'anesthésie légère, une augmentation des battements du cœur, jusqu'à 20 % – le cœur tente de compenser la chute de tension. À dose plus importante, c'est-à-dire avec une anesthésie plus profonde, le cœur se contracte de moins en moins, la pression sanguine chute, alors même que le système vasomoteur n'arrive plus à envoyer le sang vers le cœur, qui meurt, asphyxié.
- Il provoque une acidose lors de l'anesthésie, puis une alcalose (compensation) au réveil.
- Il provoque une oligurie, anurie (à la suite d'une irritation rénale, avec libération de l'hormone antidiurétique hypophysaire, notamment chez le chien).
- Il induit une atonie musculaire (à la suite d'un effet bloquant du muscle – effet curariforme – et à l'inhibition des voies pyramidales et extrapyramidales du SNC).
- Il induit l'apparition dans le plasma sanguin de corticotrophine (ACTH) et, plus encore, de corticostérone (attribuée au stress).
- Au-delà d'une certaine dose, il induit une irritation du tractus respiratoire, avec une sécrétion des muqueuses anormalement abondante.
- Il induit un dessèchement et un craquellement de la peau en cas d'exposition prolongée, à la suite de la dissolution des lipides de la peau.
- Il cause des lésions de l'œil, en cas de contact direct ou de contact avec ses vapeurs.
Chez le rat (dans la nourriture), la « dose sans effet nocif » NOAEL est de 500 mg·kg-1·j-1, mais le rat semble bien moins sensible à l'éther que la souris. Il résiste à l'inhalation de 10 000 ppm 24 h/j durant 35 j, ce qui tue 25 % des souris ou cobayes soumis au même test[20].
Alors que les nouveau-nés ou individus jeunes sont habituellement plus sensibles aux toxiques que les adultes, chez l'animal, c'est le phénomène inverse avec l'éther : les nouveau-nés résistent 5 à 6 fois plus longtemps que l'adulte à une concentration létale, et ils supportent une concentration sanguine 2,5 à 3 fois plus élevée[20].
Usage comme psychotrope
L'éther est parfois utilisé comme substance psychoactive par inhalation des vapeurs. On parle alors d'éthéromanie.
Sa consommation engendre des mouvements incontrôlés, des spasmes, une incapacité à parler intelligiblement. Une consommation régulière peut engendrer une dépendance physique et psychique forte. L'éther, après avoir connu une vogue à la fin du XIXe siècle, est revenu en force dans les années 1970 et 1980, surtout dans les États d'Amérique, où une sévère traque au cannabis était opérée. Certains consommateurs d’éther inhalaient jusqu'à 5 000 ml par jour[réf. nécessaire]. D'autres éthéromanes en consomment par voie orale, mélangé à de l'alcool — alcool dénaturé de pharmacie —, ce qui en prolonge les effets. L'usage régulier d’éther peut provoquer, comme celui d'éthanol, des nécroses tissulaires, principalement au niveau du foie et du cerveau. L'usage d’éther peut aussi causer des troubles psychiatriques souvent irréversibles : manie, démence, dépression, insomnie, etc. L'éther est considéré, avec l'alcool et les amphétamines, comme la drogue engendrant le plus de dégâts. Aujourd'hui, l'usage d'éther en tant que drogue est devenu très rare. Cependant, il commence à revenir à la mode dans les quartiers et pays défavorisés.
Effets recherchés : bien-être intense et puissant — rush — durant quelques minutes, suivi d'un état d'euphorie pouvant, si la dose inhalée est élevée, persister durant des heures, hallucinations, rêveries, désinhibition — proche de celle provoquée par l'alcool —, effet entactogène — envie de parler —, augmentation de la libido — envie sexuelle —, somnolence, antalgie — suppression de la douleur —, sensation de légèreté.
Signes d'éthéromanie : une odeur éthérée caractéristique et forte, un comportement déplacé — euphorie, agitation, fou rire, effet entactogène, etc. —, une démarche incertaine comparable à celle provoquée par l'alcool, une hypersomnie, etc., sont les principaux signes qu'on peut détecter chez un éthéromane.
Chez l'humain, l'anesthésie apparaît à 10 à 15 % du volume (150 000 ppm). Dans quelques cas, elle induit une narcose ou d'autres troubles au réveil.
Précautions
Le diéthyl éther est extrêmement inflammable. Ses vapeurs sont plus denses que l'air et ont tendance en l'absence de ventilation spéciale appropriée à s'accumuler dans les bas. Il convient d'utiliser une hotte aspirante spécialisée.
L'éther forme facilement des peroxydes explosifs au contact de l'air, sous l'action de la lumière. Le mélange avec de l'hydroxytoluène butylé (BHT) permet de le stabiliser. C'est pourquoi il est vendu dans des bouteilles bleu foncé et sa durée de conservation est limitée.
Notes et références
- ETHER DIETHYLIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 978-0-471-98369-9 et 0-471-98369-1)
- « DIETHYL ETHER » dans la base de données Hazardous Substances Data Bank (consulté le 19 novembre 2012)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) J.G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, New York, McGraw-Hill, , 16e éd., 1623 p. (ISBN 978-0-07-143220-7 et 0071432205), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9 et 0-07-049841-5), p. 2-50
- (en) David R. Lide, Handbook of Chemistry and Physics, , 89e éd., chap. 6 (« Viscosity of Liquids »), p. 177
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 978-0-88415-857-8 et 0-88415-857-8)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Éther diéthylique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Ethyl ether », sur hazmap.nlm.nih.gov (consulté le )
- Dictionnaire des sciences naturelles, Le Normant, 1819, p. 442. Voir aussi (de) Frobenius, August Sigmund sur wikisource.
- Jean Boulaine et Jean-Paul Legros, D'Olivier de Serres à René Dumont. Portraits d'agronomes, TEC & DOC Lavoisier, 1998 (ISBN 2-7430-0289-1), p. 26
- Fiche toxicologique INRS, version 2007
Voir aussi
Articles connexes
Liens externes
- (en) « Ether », Erowid.
- « Oxyde de diéthyle - FT n° 10 », fiche toxicologique de l'INRS, 2007.
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie