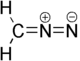
Diazométhane
Le diazométhane est le composé organique de formule brute CH2N2. C'est le composé diazo le plus simple. Pur, c'est un gaz jaune, mais en pratique il est utilisé en solution dans l'éther diéthylique. Il est toxique et explosif quand il est exposé à de hautes températures ou à du verre à peine rugueux, au point qu'il existe un type de verrerie adapté à sa préparation et usage.
| Diazométhane | |
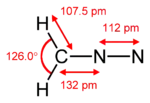  Géométrie et structure du diazométhane Formes mésomères  Molécule en représentation 3D |
|
| Identification | |
|---|---|
| Nom UICPA | diazométhane |
| No CAS | |
| No ECHA | 100.005.803 |
| No CE | 206-382-7 |
| PubChem | 9550 |
| SMILES | |
| InChI | |
| Apparence | gaz jaune |
| Propriétés chimiques | |
| Formule | CH2N2 [Isomères] |
| Masse molaire[1] | 42,04 ± 0,001 3 g/mol C 28,57 %, H 4,8 %, N 66,64 %, |
| Moment dipolaire | 1,50 ± 0,01 D [2] |
| Propriétés physiques | |
| T° fusion | −145 °C |
| T° ébullition | −23 °C |
| Masse volumique | densité:1.4 (air=1) |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 8,999 ± 0,001 eV (gaz)[3] |
| Précautions | |
| Directive 67/548/EEC | |
 T |
|
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[4] | |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |

Préparation
Le diazométhane est habituellement préparé en solution dans l'éther diéthylique et utilisé immédiatement.
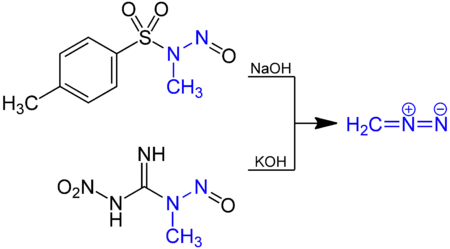
Il est synthétisé en dissolvant du diazald (N-méthyl-N-nitroso-p-toluènesulfonamide) dans une solution d'hydroxyde de potassium (KOH) dans l'éthanol. Le diazométhane est le gaz produit, recueilli par condensation à −70 °C.
En laboratoire, le diazométhane peut être préparé en quantité millimolaire à partir de nombreux précurseurs tels que le diazald ou le MNNG (1-méthyl-3-nitro-1-nitrosoguanidine)[5]. Du diazald en solution dans de l'éther diéthylique et du diglyme réagit avec une solution aqueuse chaude d'hydroxyde de sodium (NaOH) et le diazométhane généré est extrait par distillation.
Le diazométhane est aussi libéré d'une solution de MNNG dans l'éther par addition d'un solution d'hydroxyde de potassium à basse température.
Une autre voie possible pour la synthèse du diazométhane est l'hydrolyse basique de la N-nitroso-N-méthylurée.
Titrage
La concentration d'une solution de diazométhane peut être déterminée de deux façons :
- par traitement de la solution avec un excès d'acide benzoïque dans l'éther ; l'acide qui n'a pas réagi est titrée avec une solution de NaOH standard.
- par spectrométrie à 410 nm où son coefficient d'extinction molaire, ε est égal à 7,2.
Réactions
Le diazométhane peut être utilisé pour convertir les acides carboxyliques en leur ester méthylique ou leurs homologues (réaction d'Arndt-Eistert).
Dans la réaction de Buchner-Curtius-Schlotterbeck (1885), le diazométhane réagit avec un aldéhyde pour former une cétone.
Le diazométhane est utilisé comme source de carbène. Il est l'un des principaux réactifs de réactions de cycloadditions dipolaires 1,3 .
Le diazométhane réagit avec une solution basique de NaDO (D = 2H, deutérium) dans D2O pour donner CD2N2[6].
Composés
Beaucoup de dérivés substitués du diazométhane ont été préparés, parmi les plus importants :
- Le très stable (CF3)2CN2 (p.e. 12 à 13 °C)[7].
- Ph2CN2 (p.f. 29 à 30 °C)[8].
- Le triméthylsilyldiazométhane, (CH3)3SiCHN2 qui est commercialement disponible en solution et qui est un agent méthylant aussi bon que le diazométhane, sans être ni explosif, ni mutagène[9].
- PhC(H)N2, un liquide rouge avec p.e. < 25 °C à 1 mmHg[10].
- Le diazoacétate d'éthyle, EtO2CCHN2, comme source de carbène, aussi disponible commercialement car stabilisé par la fonction ester[11].
Sécurité
Le diazométhane est toxique par inhalation et contact avec la peau ou les yeux (TLV 0,2 ppm). Les symptômes incluent douleurs thoraciques, maux de tête, faiblesse générale et dans les cas sévères, collapsus[12]. Des morts par empoisonnement avec le diazométhane ont été reportées. Dans un cas, un laborantin qui avait mangé un hamburger à côté d'une hotte aspirante où il avait préparé une large quantité de diazométhane, est mort quatre jours après d'une pneumonie fulgurante[13]. Le diazométhane peut exploser s'il est en contact avec un joint en verre rodé ou s'il est chauffé à plus de 100 °C. Conséquemment, une verrerie spéciale sans éraflure ni rayure et un écran de protection doivent être employés lors de son usage.
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Diazomethane » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- J. A. Moore; D. E. Reed, Diazomethane, OrgSynth, 1973, collvol = 5, p. 351.
- P. G. Gassman and W. J. Greenlee, Dideuterodiazomethane,OrgSynth, 1988, collvol = 6, p. 432.
- W. J. Middleton; D. M. Gale, Bis(Trifluoromethyl))diazomethane, OrgSynth, 1988, collvol = 6, p. 432.
- L. I. Smith, K. L. Howard, Diphenyldiazomethane, 1955, collvol = 3, p. 351.
- T. Shioiri, T. Aoyama, S. Mori, Trimethylsilyldiazomethane, OrgSynth, 1993, collvol = 8, p. 612.
- X. Creary, Tosylhydrazone Salt Pyrolyses: Phenydiazomethanes, OrgSynth, 1990, collvol = 7, p. 438.
- N. E. Searle, , Ethyl diazoacetate, OrgSynth, 1963, collvol = 4, p. 424.
- Hazards in the Chemical Laboratory, Muir, GD (ed.) 1971, The Royal Institute of Chemistry, London.
- Diazomethane Poisoning: Report of a fatal case with autopsy, LeWinn, E.B.; The American Journal of the Medical Sciences, 1949, 218, p. 556-562.
Liens externes
- MSDS diazométhane
- Sigmaaldrich technical bulletin (PDF)
- Sigma-Aldrich diazomethane applications and commercial availability of (Diazald) precursor.
- The Buchner-Curtius-Schlotterbeck reaction @ Institute of Chemistry, Skopje, Macedonia
- Portail de la chimie