Dichlorure de titanocène
Le dichlorure de titanocène est un composé organotitane de formule chimique (η5-C5H5)2TiCl2, couramment abrégée Cp2TiCl2, où Cp représente un ligand cyclopentadiényle C5H5. Ce métallocène est un réactif employé en synthèse organique et organométallique. Il se présente comme une poudre rouge vif qui s'hydrolyse lentement au contact de l'air. Il présente également une activité antitumorale et a été le premier complexe non platine à faire l'objet d'un essai clinique en chimiothérapie[3].
| Dichlorure de titanocène | |

| |
| Structure du dichlorure de titanocène | |
| Identification | |
|---|---|
| Synonymes |
dichlorure de dicyclopenta-1,3-dién-1-yltitane |
| No CAS | |
| No ECHA | 100.013.669 |
| No CE | 215-035-9 |
| No RTECS | XR2050000 |
| PubChem | 5284468 |
| SMILES | |
| InChI | |
| Apparence | poudre rouge[1] |
| Propriétés chimiques | |
| Formule | (C5H5)2TiCl2 |
| Masse molaire[2] | 248,959 ± 0,014 g/mol C 48,24 %, H 4,05 %, Cl 28,48 %, Ti 19,23 %, |
| Propriétés physiques | |
| T° fusion | 287 à 289 °C[1] (décomposition) |
| Solubilité | s'hydrolyse dans l'eau[1] |
| Masse volumique | 1,600 g/cm3[1] |
| Précautions | |
| SGH[1] | |
 Attention |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure et préparation
Le complexe Cp2TiCl2 adopte une géométrique tétraédrique distordue, si l'on assimile les unités cyclopentadiène à des ligands monodentates — elles sont liés au titane par une liaison haptique η5. La liaison Ti–Cl a une longueur de 237 pm, tandis que l'angle Cl–Ti–Cl vaut 95°[4].
Le mode de préparation standard du dichlorure de titanocène part du tétrachlorure de titane TiCl4. La synthèse à partir de cyclopentadiénure de sodium Na(C5H5)[5] est encore couramment utilisée :
Il peut également être obtenu à partir de cyclopentadiène C5H6 fraîchement distillé plutôt qu'à partir de son sel de sodium[6] :
Réactions
Remplacement de ligands chlorure
Le dichlorure de titanocène est un réactif efficace comme source d'unités Cp2Ti2+. Les ligands chlorure peuvent être déplacés par une large gamme de nucléophiles. L'hydrogénosulfure de sodium NaSH et les polysulfures donnent respectivement des dérivés Cp2Ti(SH)2 et Cp2TiS5[7].
Le réactif de Petasis, ou diméthyltitanocène Cp2Ti(CH3)2, est obtenu en faisant réagir du dichlorure de titanocène avec du chlorure de méthylmagnésium CH3MgCl[8] ou du méthyllithium CH3Li[9] ; il est utile pour les conversion des esters en éthers d'énol.
- Cp2TiCl2 + 2 CH3MgCl ⟶ Cp2Ti(CH3)2 + 2 MgCl2.
Le réactif de Tebbe Cp2Ti(µ-CH2)(µ-Cl)Al(CH3)2 s'obtient en faisant réagir deux équivalents de triméthylaluminium (CH3)3Al avec du dichlorure de titanocène[10],[11] :
- Cp2TiCl2 + 2 Al(CH3)3 ⟶ CH4 + Cp2Ti(µ-CH2)(µ-Cl)Al(CH3)2 + (CH3)2AlCl.
Remplacement de ligands cyclopentadiényle
Un ligand cyclopentadiényle peut être éliminé du Cp2TiCl2 pour donner du CpTiCl3 à géométrie tétraédrique. Cette conversion peut être réalisée à l'aide de tétrachlorure de titane TiCl4 ou de chlorure de thionyle SOCl2[12].
Le composé sandwich (cycloheptatriényl)(cyclopentadiényl)titane (η7-C7H7)(η5-C5H5)Ti (troticène) peut être obtenu par traitement de dichlorure de titanocène avec du cycloheptatriényllithium[13].
Le titanocène Cp2Ti est lui-même si réactif qu'il se réarrange en dimère d'hydrures à titaneIII qui a fait l'objet de nombreuses études. Ce dimère peut être piégé en conduisant la réduction du dichlorure de titanocène en présence de ligands. Avec du benzène, on peut obtenir un complexe de fulvalène μ(η5:η5-fulvalène)-di-(μ-hydrido)-bis(η5-cyclopentadiényltitane), et le soluté résultant peut être caractérisé par cristallographie aux rayons X[14].
Le même composé avait été publié plus tôt par une réduction du dichlorure de titanocène par l'aluminohydrure de lithium LiAlH4[15] et par l'amalgame de sodium Na(Hg)[16] et étudié par RMN du proton[17] avant sa caractérisation définitive.
Réduction
La réduction du dichlorure de titanocène Cp2TiCl2 (ci-dessous en rouge) donne le chlorure de bis(cyclopentadiényl)titane(III) [(η5-C5H5)2Ti(µ-Cl)]2 (réactif de Nugent-RajanBabu, ci-dessous en vert) en équilibre chimique avec le solvant[18],[19] :
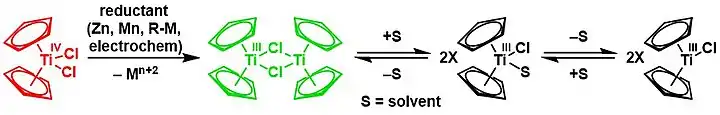
Le dichlorure de titanocène est précurseur de dérivés de titane(II). On a notamment étudié les réductions aux réactifs de Grignard et aux composés alkyllithium. Parmi les réducteurs les plus pratiques, on peut retenir le magnésium, l'aluminium et le zinc. Les exemples suivants illustrent certains des composés qui peuvent être produits par réduction du dichlorure de titanocène en présence de ligands π-accepteurs[20] :
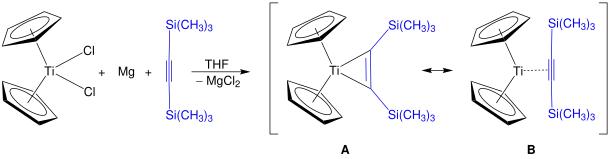
On connaît des dérivés alkylés du titanocène de formule Cp2TiC2R2 ainsi que les complexes de benzyne correspondants[21], voire des titanocyclopentadiènes[22]. Le réactif de Rosenthal Cp2Ti(η2-Me3SiC≡CSiMe3) peut être obtenu de cette manière ; la réaction ci-dessous illustre les deux mésomères A et B de ce réactif[23] :
La réaction d'équivalents de titanocène réagissent avec des alcénylalcynes suivie d'une carbonylation et d'une hydrolyse peut mener à la formation de cyclopentadiénones bicycliques de manière apparentée à une réaction de Pauson-Khand (en)[24]. La cyclisation réductrice des énones est également susceptible de conduire à l'alcool correspondant de manière stéréosélective[25].
La réduction du dichlorure de titanocène en présence de diènes conjugués tel quel le 1,3-butadiène donne des complexes η3-allyltitane[26]. On observe des réactions apparentées avec des diynes. Le titanocène peut également catalyser la métathèse de liaisons C–C pour former des diynes asymétriques[22].
Dérivés du dichlorure de décaméthyltitanocène
On connaît de nombreux analogues du dichlorure de titanocène. Les plus emblématiques sont les dérivés méthylés (η5-C5H4Me)2TiCl2 et (η5-C5Me5)2TiCl2. Le complexe d'éthylène (η5-C5Me5)2Ti(η2-C2H4) peut être obtenu par réduction au sodium de (η5-C5Me5)2TiCl2 en présence d'éthylène. L'analogue non méthylé n'a pas été observée. Ces espèces à pentaméthylcyclopentadiényle, noté Cp*, interviennent dans de nombreuses réactions telles que des cycloadditions d'alcynes[21].
Notes et références
- « Fiche du composé Bis(cyclopentadienyl)titanium dichloride, 99+% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) R. M. Roat-Malone, Bioinorganic Chemistry: A Short Course, 2e éd., John Wiley & Sons, 2007, p. 19–20. (ISBN 978-0-471-76113-6)
- (en) Abraham Clearfield, David Keith Warner, Carlos Herman Saldarriaga-Molina, Ramanathan Ropal et Ivan Bernal, « Structural Studies of (π-C5H5)2MX2 Complexes and their Derivatives. The Structure of Bis(π-cyclopentadienyl)titanium Dichloride », Canadian Journal of Chemistry, vol. 53, no 11, , p. 1621-1629 (DOI 10.1139/v75-228, lire en ligne)
- (en) G. Wilkinson et J. M. Birmingham, « Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta », Journal of the American Chemical Society, vol. 76, no 17, , p. 4281-4284 (DOI 10.1021/ja01646a008, lire en ligne)
- (en) John M. Birmingham, « Synthesis of Cyclopentadienyl Metal Compounds », Advances in Organometallic Chemistry, vol. 2, , p. 365-413 (DOI 10.1016/S0065-3055(08)60082-9, lire en ligne)
- (en) Alan Shaver, James M. Mccall, Gabriela Marmolejo, F. Bottomley, E. C. Ferris et J. A. Gladysz, « Cyclometallapolysulfanes (and Selanes) of Bis(η5-Cyclopentadienyl) Titanium(IV), Zirconium(IV), Molybdenum(IV), and Tungsten(IV) », Inorganic Syntheses, vol. 27, (DOI 10.1002/9780470132586.ch11, lire en ligne)
- (en) Joseph F. Payack , David L. Hughes , Dongwei Cai , Ian F. Cottrell et Thomas R. Verhoeven, « Dimethyltitanocene », Organic Syntheses, vol. 79, , p. 19 (DOI 10.15227/orgsyn.079.0019, lire en ligne)
- (de) Karl Clauss et Herbert Bestian, « Über die Einwirkung von Wasserstoff auf einige metallorganische Verbindungen und Komplexe », Justus Liebigs Annalen der Chemie, vol. 654, no 1, (DOI 10.1002/jlac.19626540103, lire en ligne)
- (en) Wolfgang A. Herrmann, « The Methylene Bridge », Advances in Organometallic Chemistry, vol. 20, , p. 159-263 (DOI 10.1016/S0065-3055(08)60522-5, lire en ligne)
- (en) Daniel A. Straus, M. Monzur Morshed, Matthew E. Dudley et M. Mahmun Hossain, « μ-Chlorobis(cyclopentadienyl)(dimethylaluminum)-μ-methylenetitanium », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rc073.pub2, lire en ligne)
- (en) Kailash Chandra, R. K. Sharma, Narendra Kumar et B. S. Garg, « Preparation of η5-Cyclopentadienyltitanium Trichloride and η5-Methylcyclopentadienyltitanium Trichloride », Chemistry & Industry, vol. 1, no 7, , p. 288-289
- (en) Luana C. de Camargo, Matteo Briganti, Francielli S. Santana, Danilo Stinghen, Ronny R. Ribeiro, Giovana G. Nunes, Jaísa F. Soares, Enrico Salvadori, Mario Chiesa, Stefano Benci, Renato Torre, Lorenzo Sorace, Federico Totti et Roberta Sessoli, « Exploring the Organometallic Route to Molecular Spin Qubits: The [CpTi(cot)] Case », Angewandte Chemie International Edition, vol. 60, no 5, , p. 2588-2593 (PMID 33051985, DOI 10.1002/anie.202009634, S2CID 222351619, lire en ligne)
- (en) Sergei I. Troyanovm Helena Antropiusová et Karel Mach, « Direct proof of the molecular structure of dimeric titanocene; The X-ray structure of μ(η5:η5-fulvalene)-di-(μ-hydrido)-bis(η5-cyclopentadienyltitanium)· 1.5 benzene », Journal of Organometallic Chemistry, vol. 427, no 1, , p. 49-55 (DOI 10.1016/0022-328X(92)83204-U, lire en ligne)
- (en) Helena Antropiusová, Alena Dosedlová, Vladimír Hanuš et Karel Mach, « Preparation of μ-(η5:η5-Fulvalene)-di-μ-hydrido-bis(η5-cyclopentadienyltitanium) by the reduction of Cp2TiCl2 with LiAlH4 in aromatic solvents », Transition Metal Chemistry, vol. 6, , p. 90-93 (DOI 10.1007/BF00626113, S2CID 101189483, lire en ligne)
- (en) Tomas Cuenca, Wolfgang A. Herrmann et Terence V. Ashworth, « Chemistry of oxophilic transition metals. 2. Novel derivatives of titanocene and zirconocene », Organometallics, vol. 5, no 12, , p. 2514-2517 (DOI 10.1021/om00143a019, lire en ligne)
- (en) D. A. Lemenovskii, I. F. Urazowski, Yu. K. Grishin et V. A. Roznyatovsky, « 1H NMR Spectra and electronic structure of binuclear niobocene and titanocene containing fulvalene ligands », Journal of Organometallic Chemistry, vol. 290, no 3, , p. 301-305 (DOI 10.1016/0022-328X(85)87293-4, lire en ligne)
- (en) L. E. Manzer, E. A. Mintz et T. J. Marks, « 18. Cyclopentadienyl Complexes of Titanium(III) and Vanadium(III) », Inorganic Syntheses, vol. 21, (DOI 10.1002/9780470132524.ch18, lire en ligne)
- (en) William A. Nugent et T. V. RajanBabu, « Transition-metal-centered radicals in organic synthesis. Titanium(III)-induced cyclization of epoxy olefins », Journal of the American Chemical Society, vol. 110, no 25, , p. 8561-8562 (DOI 10.1021/ja00233a051, lire en ligne)
- (en) Erik Kuester, « Bis(η5-2,4-cyclopentadienyl)bis(trimethylphosphine)titanium », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rn00022, lire en ligne)
- (en) Stephen L. Buchwald et Ralph B. Nielsen, « Group 4 metal complexes of benzynes, cycloalkynes, acyclic alkynes, and alkenes », Chemical Reviews, vol. 88, no 7, , p. 1047-1058 (DOI 10.1021/cr00089a004, lire en ligne)
- (en) Uwe Rosenthal, Paul-Michael Pellny, Frank G. Kirchbauer et Vladimir V. Burlakov, « What Do Titano- and Zirconocenes Do with Diynes and Polyynes? », Accounts of Chemical Research, vol. 33, no 2, , p. 119-129 (PMID 10673320, DOI 10.1021/ar9900109, lire en ligne)
- (en) Uwe Rosenthal, Vladimir V. Burlakov, Perdita Arndt, Wolfgang Baumann et Anke Spannenberg, « The Titanocene Complex of Bis(trimethylsilyl)acetylene: Synthesis, Structure, and Chemistry », Organometallics, vol. 22, no 5, , p. 884-900 (DOI 10.1021/om0208570, lire en ligne)
- (en) Frederick A. Hicks, Natasha M. Kablaoui et Stephen L. Buchwald, « Scope of the Intramolecular Titanocene-Catalyzed Pauson−Khand Type Reaction », Journal of the American Chemical Society, vol. 121, no 25, , p. 5881-5898 (DOI 10.1021/ja990682u, lire en ligne)
- (en) Natasha M. Kablaoui et Stephen L. Buchwald, « Development of a Method for the Reductive Cyclization of Enones by a Titanium Catalyst », Journal of the American Chemical Society, vol. 118, no 13, , p. 3182-3191 (DOI 10.1021/ja954192n, lire en ligne)
- (en) Fumie Sato, Hirokazu Urabe et Sentaro Okamoto, « Synthesis of Organotitanium Complexes from Alkenes and Alkynes and Their Synthetic Applications », Chemical Reviews, vol. 100, no 8, , p. 2835-2886 (PMID 11749307, DOI 10.1021/cr990277l, lire en ligne)
- Portail de la chimie
