Dihydroptéroate synthase
La dihydroptéroate synthase est une enzyme classée par la nomenclature EC en tant que 2.5.1.15[1], présente dans la biosynthèse de la tétrahydrométhanoptérine chez les archées[2],[3] et de l’acide folique chez les bactéries, les champignons et les plantes, mais pas chez les animaux[2],[3].
| N° EC | EC |
|---|---|
| N° CAS |
Synonymie
Cette enzyme porte 111 synonymes[3] dont « DHPS », « dihydro|pteroate diphosphorylase » ou « dihydropteroate pyrophosphorylase »[1].
Rôle
Les cofacteurs folate dans leurs formes réduites sont nécessaires aux différents organismes pour la synthèse de nombreux métabolites essentiels. Les cellules des vertébrés possèdent des systèmes de transports actifs qui leur permettent d'assimiler le folate provenant de l'alimentation. L'absence d'un tel système chez la plupart des microorganismes implique qu'ils doivent synthétiser de novo le folate. Les protéines contenant un domaine capable de synthèse de folate incluent la dihydroptéroate synthase (EC 2.5.1.15) ainsi qu'un groupe d'enzymes méthyltransférases y compris la protéine méthyltétrahydrofolate:corrinoid fer-sulfure méthyltransférase (MeTr)[4] qui catalyse une étape clé de la voie Wood-Ljungdahl impliquée dans la fixation du dioxyde de carbone.
Gènes et protéines
L'activité enzymatique dihydroptéroate synthase est portée par des protéines multifonctionnelles très différentes les unes des autres en fonction des microorganismes[1].
- Gène sul1 chez Escherichia coli, Corynebacterium et Pseudomonas
- Gène sul2 chez Escherichia coli
- Gène folP chez les Staphylocoques, les Streptocoques et Neisseria meningitidis
- Gène folP1 chez Mycobacterium tuberculosis et autres mycobactéries
- Gène folP-A et folP-B chez Haemophilus influenzae
- Gène fol1 chez Pneumocystis jirovecii (anciennement P. carinii), Dictyostelium discoideum et Saccharomyces cerevisiae[5]
- Gène PjFAs ou fas chez Pneumocystis jirovecii codant la protéine tri-fonctionnelle FAS[6]
- Gène folKP chez Chlamydia pneumoniae
Structure
Elle se structure en un dimère dans une solution, étudié depuis le staphylocoque doré[7], voire un tétramère (pfPPPK-DHPS[note 1]), étudié depuis le Plasmodium falciparum[8].
Métabolisme
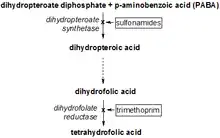
L'enzyme Dihydroptéroate synthase (EC 2.5.1.15) (DHPS) catalyse la condensation du 6-hydroxymethyl-7,8-dihydroptéridine pyrophosphate en acide para-aminobenzoïque pour former le 7,8-dihydroptéroate. Il s'agit là de la seconde étape sur les 3 de la voie menant à la formation de 7,8-dihydrofolate à partir de 6-hydroxymethyl-7,8-dihydroptérine.
Cible thérapeutique
La DHPS est la cible des sulfonamides, qui sont des substrats analogues qui entrent en compétition avec l'acide para-aminobenzoïque (pABA)[9]. Les DHPS bactériennes (codées par le gène sul ou folP)[10] sont des protéines de 275 à 315 acides aminés codées soit dans un chromosome soit dans un plasmide contenant des gènes de résistance aux antibiotiques. Chez le fungi Pneumocystis jirovecii, l'activité DHPS est portée par le domaine C-terminal d'une enzyme multifonctionnelle et capable de synthèse du folate (gene fas)[6],[11]. Des mutations ont été associées à l'émergence de souches résistantes chez les patients atteints de pneumonies dues à cette espèce et traités par des sulfonamides[12]. La prévalence géographique et la diffusion des mutations chez P. jirovecii serait reliée à l'utilisation des sulfonamides ainsi qu'aux transmissions entre malades[12]. Le lien entre les mutations, la résistance aux sulfonamides et une évolution clinique plus grave chez les malades, même si elle a été confirmée dans certaines études reste à être démontrée sur des études plus larges[13].
Notes et références
Notes
- Voir « Nomemclature » IUPHAR (en).
Références
- (en) « ENZYME entry: EC 2.5.1.15 »
- « IUBMB Enzyme Nomenclature : EC 2.5.1.15 » (consulté le )
- « Information on EC 2.5.1.15 - dihydropteroate synthase »
- « UniProtKB - Q46389 (ACSE_MOOTH) », sur Uniprot, (consulté le )
- Carmen de la Horra et al. 2021, p. 9.
- Carmen de la Horra et al. 2021, p. 10.
- Hampele et al. 1997, Abstract.
- W. Kasekarn et al. 2004, Abstract.
- Carmen de la Horra et al. 2021, p. 1.
- (en) I.P. Crawford, J. Slock, D.P. Stahly, E.W. Six et C.Y. Han, « An apparent Bacillus subtilis folic acid biosynthetic operon containing pab, an amphibolic trpG gene, a third gene required for synthesis of para-aminobenzoic acid, and the dihydropteroate synthase gene », J. Bacteriol., vol. 172, no 12, , p. 7211–7226 (PMID 2123867, PMCID 210846, DOI 10.1128/jb.172.12.7211-7226.1990)
- (en) F. Volpe, M. Dyer, J.G. Scaife, G. Darby, D.K. Stammers et C.J. Delves, « The multifunctional folic acid synthesis fas gene of Pneumocystis carinii appears to encode dihydropteroate synthase and hydroxymethyldihydropterin pyrophosphokinase », Gene, vol. 112, no 2, , p. 213–218 (PMID 1313386, DOI 10.1016/0378-1119(92)90378-3)
- Carmen de la Horra et al. 2021, p. 10-11.
- Carmen de la Horra et al. 2021, p. 11.
Voir aussi
Articles connexes
Bibliographie
- (en) M.A. Jarboui, A. Sellami, H. Sellami, F. Cheikhrouhou, F. Makni et A. Ayadi, « Dihydropteroate synthase gene mutations in Pneumocystis jiroveci strains isolated from immunocompromised patients », Pathologie Biologie, vol. 59, , p. 222-225 (ISSN 0369-8114, DOI https://doi.org/10.1016/j.patbio.2010.02.001, lire en ligne)
- (en) Isabelle C Hampele, Allan D’Arcy, Glenn E Dale, Dirk Kostrewa, Jørgen Nielsen, Christian Oefner, Malcolm G.P Page, Hans-Joachim Schönfeld, Dietrich Stüber et Rudolf L Then, « Structure and function of the dihydropteroate synthase from staphylococcus aureus11 », Journal of Molecular Biology, R. Huber, vol. 268, , p. 21-30 (ISSN 0022-2836, DOI https://doi.org/10.1006/jmbi.1997.0944, lire en ligne)
- (en) Kasekarn, W., Sirawaraporn, R., Chahomchuen, T., Cowman, A. F. et irawaraporn, W., « Molecular characterization of bifunctional hydroxymethyldihydropterin pyrophosphokinase-dihydropteroate synthase from Plasmodium falciparum », Molecular and biochemical parasitology, vol. 137, , p. 43–53 (DOI https://doi.org/10.1016/j.molbiopara.2004.04.012)
- (en) Carmen de la Horra, Vicente Friaza, Rubén Morilla, Juan Delgado, Francisco J. Medrano, Robert F. Miller, Yaxsier de Armas et Enrique J. Calderón, « Update on Dihydropteroate Synthase (DHPS) Mutations in Pneumocystis jirovecii », Journal of Fungi, vol. 7, no 10, , p. 856 (PMID 34682277, DOI 10.3390/jof7100856)
- Portail de la biochimie